
| A. | 150mL 0.4mol/L的HCl | B. | 250mL 0.2mol/L的AlCl3 | ||
| C. | 250mL 0.3mol/L的BaCl2 | D. | 100mL 0.2mol/L的NaCl |
分析 50mL 0.2mol/L的MgCl2溶液中的Cl-的物质的量浓度为:0.2mol/L×2=0.4mol/L,然后根据化学式中各微粒的浓度=溶质的物质的量浓度×离子个数,与溶液的体积无关,据此进行判断.
解答 解:50mL 0.2mol/L的MgCl2溶液中的Cl-的物质的量浓度为:0.2mol/L×2=0.4mol/L,
A.150mL 0.4mol/L的HCl溶液中Cl-的物质的量浓度为:c(Cl-)=c(HCl)=0.4mol/L,故A正确;
B.250mL 0.2mol/L的AlCl3溶液中Cl-的物质的量浓度为:c(Cl-)=3c(AlCl3)=0.6mol/L,故B错误;
C.250mL 0.3mol/L的BaCl2溶液中Cl-的物质的量浓度为:c(Cl-)=2c(BaCl2)=0.6mol/L,故C错误;
D.100mL0.2mol/L的NaCl溶液溶液中Cl-的物质的量浓度为:c(Cl-)=c(NaCl)=0.2mol/L,故D错误;
故选A.
点评 本题考查物质的量浓度的计算与判断,题目难度中等,注意溶液中离子的物质的量浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.


科目:高中化学 来源: 题型:选择题
| A. | 点样后应在滤纸上形成一个直径较大的样斑,便于实验时观察 | |
| B. | 展开剂可以既是流动相又是固定相 | |
| C. | 为使层析实验有较好的分离效果,试样溶液浓度应较小 | |
| D. | 纸层析法简称纸层析,是色谱分析法的一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2$\frac{\underline{\;500℃\;}}{V_{2}O_{5}}$2SO3△H=-196.6 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ | |
| D. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应停止 | B. | N2、H2、NH3的浓度均相等 | ||
| C. | N2、H2、NH3的浓度保持不变 | D. | N2的消耗速率等于NH3的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
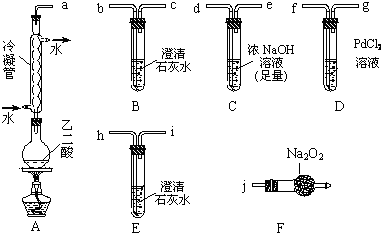
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  将海带灼烧成灰 | B. |  过滤得含I-溶液 | ||
| C. |  萃取后分层碘的CCl4溶液 | D. | 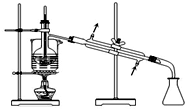 分离碘并回收CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并带有浓烟 | |
| C. | 反应③为取代反应,浓硫酸是反应物 | |
| D. | 反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据如图原电池的装置图回答下列问题:
根据如图原电池的装置图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al是还原剂,NaOH及H2O均是氧化剂 | |
| B. | 还原产物是H2,且由H2O还原所得的H2与NaOH还原所得的H2物质的量的比为2:1 | |
| C. | 反应中1mol Al失去4mol电子 | |
| D. | 此反应中,只有水是氧化剂,NaOH既不是氧化剂也不是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com