
【题目】海洋资源的利用具有广阔前景。
(1)海水淡化的方法有_____(选填一种即可)。
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是____。
(3)下图是从海水中提取镁的简单流程。
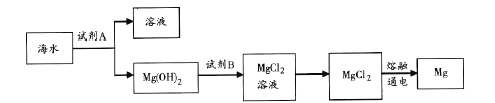
工业上常用于沉淀Mg2+的试剂A 的俗名是___,Mg(OH)2转化为MgCl2 的离子方程式是_______。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2 的途径如下所示:
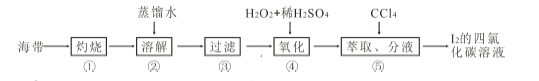
①灼烧海带至灰烬时所用的主要仪器名称是_______。步骤②加热煮沸一会的目的是______________。
② 步骤④向滤液中加H2O2 和稀H2SO4 溶液,写出该反应的离子方程式_______________。反应结束后,再加入CCl4 作萃取剂,振荡、静置,可以观察到CCl4 层呈____________色。
【答案】蒸馏法、电渗析法、离子交换法(选填一种即可) Cl2 + 2Br- = Br2 + Cl- 熟石灰或石灰乳 Mg(OH)2 + 2H+ = Mg2+ + 2H2O 坩埚 促使海带灰中含碘物质快速充分溶解 2I- + H2O2 + 2H+ = I2 + 2H2O 紫或紫红
【解析】
(1)淡水利用蒸馏原理来得到;
(2)氯气能氧化溴离子得到氯离子和单质溴;
(3)由流程可知,海水晒盐后分离出母液含镁离子,加试剂A为石灰乳(或生石灰/氧化钙),生成氢氧化镁沉淀,再与盐酸反应生成氯化镁,冷却结晶分离出晶体,在HCl气流中脱水,最后电解熔融氯化镁冶炼Mg;
(4)①灼烧固体时所用的主要仪器名称是坩埚,步骤②加热煮沸一会是促进含碘物质充分溶解;
②氢离子和过氧化氢将碘离子氧化为单质碘;碘的CCl4溶液呈紫色。
(1)把海水用蒸馏等方法可以得到淡水;
(2)氯气能氧化溴离子得到氯离子和单质溴,反应的离子方程式为2Br-+Cl2═Br2+2Cl-;
(3)工业上常用于沉淀Mg2+的试剂A是熟石灰Ca(OH)2,便于易得,Mg(OH)2转化为MgCl2的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;
(4)①灼烧固体时所用的主要仪器名称是坩埚,步骤②加热煮沸一会的目的是:促使海带灰中含碘物质快速充分溶解;
②加入氢离子和过氧化氢起的作用为氧化剂,将碘离子转化为单质碘,离子方程式为2H++2I-+H2O2═I2+2H2O,反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈紫或紫红色。


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25g·mL-1,质量分数36.5%的浓盐酸配制0.1mol·L-1的盐酸240mL,请回答下列问题:
(1)浓盐酸的物质的量浓度为_______。
(2)配制240 mL0.1mol·L-1的盐酸应选用_______mL的容量瓶,需要量取浓盐酸体积为_______mL。
(3)定容时,除了烧杯、玻璃棒、容量瓶外,还需要的玻璃仪器是_______。
(4)正确的操作顺序是________(填序号)
①用胶头滴管逐滴加水,使溶液凹液面恰好与容量瓶刻度线相切
②向容量瓶中加水至液面接近瓶颈上的刻度线1-2cm处
③根据计算,用量筒称取一定体积的浓盐酸
④将容量瓶盖紧,振荡,摇匀
⑤将浓盐酸倒入烧杯中加水稀释,并不断用玻璃棒搅拌,静置待其冷却
⑥将溶液用玻璃棒引流注入查漏过的容量瓶中
⑦少量水洗涤烧杯及玻璃棒2至3次,并将每次的洗涤液也注入容量瓶中
(5)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视刻度线,浓度_________;
②定容摇匀后发现溶液凹面低于刻度线,加水至刻度线,浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是
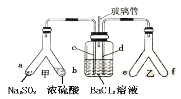
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将BaSO3氧化为BaSO4沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如下:
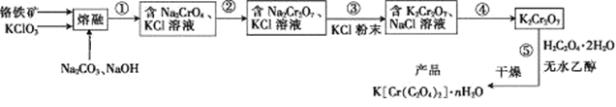
回答下列问题:
(1)若“熔融”在坩埚中进行,其材质可以是____(填“铁”、“陶瓷”或“SiO2”)。
(2) FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____________________________。
(3)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等, 步骤①包含两次过滤操作:一是水浸后过滤;二是调节所得滤液pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为______,第二次过滤滤渣的主要成分为_________。
(4)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为___________。
(5)步骤④包含的具体操作有_____、_____,过滤、洗涤,再经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)已知K[Cr(C2O4)2]的相对分子质量为267。采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80 ℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。下列说法正确的是
A.12g金刚石中含有的共价键数目为4NA
B.3.2gCu与足量浓硝酸反应生成的气体分子数为0.1NA
C.标准状况下,2.24LCH3OH中含有的电子数为1.8NA
D.常温常压下,4.4gN2O和CO2的混合气体中含有0.3NA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m克Fe2O3、Al2O3样品溶解在过量的200mL0.1mol·L-1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
A.0.1mol·L-1B.0.2mol·L-1C.0.4mol·L-1D.0.8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
B.稀硫酸与NaOH溶液反应:2H++2OH-=2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH) 2CO3+4H+=2Cu2++CO2↑+3H2O
D.向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH) 3(胶体)+3H+
Fe(OH) 3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制取少量的NOSO4H,并检验产品纯度。已知:NOSO4H遇水水解,但溶于浓硫酸而不分解。

(1)利用装置A制取SO2,下列最适宜的试剂是_____(填下列字母编号)
A.Na2SO3固体和20%硝酸 B.Na2SO3固体和20%硫酸
C.Na2SO3固体和70%硫酸 D.Na2SO3固体和18.4mol/L硫酸
(2)装置B中浓HNO3和SO2在浓H2SO4作用下反应制得NOSO4H。
①为了控制通入SO2的速率,可以采取的措施是_______。
②该反应必须维持体系温度不低于20℃。若温度过高,产率降低的可能原因是____。
③开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因可能是______。
(3)在实验装置存在可能导致NOSO4H产量降低的缺陷是______。
(4)测定NOSO4H的纯度
准确称取1.337 g产品加入250 mL碘量瓶中,加入0.1000mol/L、60.00 mL的KMnO4标准溶液和10 mL 25%H2SO4溶液,然后摇匀。用0.2500 mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO4-+___C2O42-+______=___Mn2++____+__H2O
②亚硝酰硫酸的纯度=___%(计算结果保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com