
| A. |  | B. |  | ||
| C. | CH2═CHC(CH3)2CH(CH3)2 | D. | (CH3)3CC(CH3)═CHCH3 |
分析 2,2,3-三甲基戊烷的碳链结构为 ,根据各物质与氢气完全加成后的产物与2,2,3-三甲基戊烷的碳链结构相比较判断正误.
,根据各物质与氢气完全加成后的产物与2,2,3-三甲基戊烷的碳链结构相比较判断正误.
解答 解:A.HC≡CCH(CH3)C(CH3)3与氢气完全加成后产物的碳链结构为 ,能生成2,2,3-三甲基戊烷,故A错误;
,能生成2,2,3-三甲基戊烷,故A错误;
B.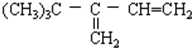 与氢气完全加成后产物的碳链结构为
与氢气完全加成后产物的碳链结构为 ,能生成2,2,3-三甲基戊烷,故B错误;
,能生成2,2,3-三甲基戊烷,故B错误;
C.CH2=CHC(CH3)2CH(CH3)2与氢气完全加成后产物的碳链结构为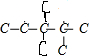 ,不能生成2,2,3-三甲基戊烷,故C正确;
,不能生成2,2,3-三甲基戊烷,故C正确;
C.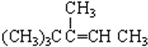 与氢气完全加成后产物的碳链结构
与氢气完全加成后产物的碳链结构 ,能生成2,2,3-三甲基戊烷,故D错误.
,能生成2,2,3-三甲基戊烷,故D错误.
故选C.
点评 本题考查加成反应,难度中等,关键清楚不饱和烃的加成原理,也可通过去相邻两个C原子的H原子还原不饱和键.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.3 mol•L-1 Na2SO4溶液中含有Na+和SO${\;}_{4}^{2-}$总物质的量为0.9 mol | |
| B. | 50mL 1 mol•L-1的KCl溶液和100mL 0.5 mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1 L水吸收22.4 L氨气所得氨水的浓度是1 mol•L-1 | |
| D. | 10℃时0.35 mol•L-1的KCl饱和溶液100 mL,蒸发掉5 g水,再冷却到10℃时,它的物质的量浓度仍为0.35 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | Y2M4和M2Z2的分子中含有不同数目的电子 | |
| C. | X2M2为直线型的共价化合物 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L酒精含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01 NA | |
| C. | 11.2 L H2所含的电子数为NA | |
| D. | 通常状况下,NA个CO2分子含有电子数为22 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com