
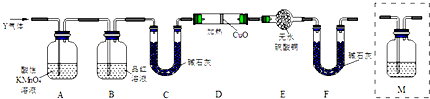
���� ��1�����������£�����Ũ�����ܲ����ۻ�����
��2�������������ӵ�����ѡȡ�Լ������������л�ԭ�ԣ�����ǿ�����Ե����ʼ��飬�ұ��������Ե�ʵ������
��3������������ʹƷ����Һ��ɫ���Ӷ�������������Ƿ���ڣ�
��4�����������ijɷַ����������е�����̼�ڼ��������¶�����Ũ���ᷢ��������ԭ��Ӧ��
��5�����ݶ�������Ͷ�����̼�����ʷ���ѡ��λ�ã�
��6���������������ʷ������������л�ԭ�ԣ��ܻ�ԭ��ɫ������ͭ������ˮ��ˮ��ʹ��ɫ����ˮ����ͭ������
��� �⣺��1�����������������У�Ũ�����н�ǿ����������ʹ�����ۻ���ֹ��Ӧ��һ�����У��ʴ�Ϊ����������Ũ������汻�ۻ���
��2��������������ʹ���Ը��������ɫ����Һ���Ѿ������������ӣ�ѡ��a����ɸ��ţ�ѡcd�������ֳ���������������������ɫ��Ӱ�����ֱ棬��ѡb��
�ʴ�Ϊ��b��
��SO2���л�ԭ�ԣ�ͨ��������ˮ�У�����SO2+Br2+2H2O=2HBr+H2SO4����Ӧ�����ӷ���ʽΪ��SO2+Br2+2H2O=2Br-+4H++SO42-�����ɵ����������Ȼ����������ɫ��������n��������壩=$\frac{0.448L}{22.4L/mol}$=0.02mol��
SO2 ��BaSO4
1mol 233g
n 2.33g
n=0.01mol
���Զ���������������Ϊ��$\frac{0.01mol}{0.02mol}$��100%=50%��
�ʴ�Ϊ��SO2+Br2+2H2O=2Br-+4H++SO42-��50%��
��3��A��ȥ����������������ʹƷ����Һ��ɫ������B���Լ���A���Ƿ���ȫ��ȥ��������������ˮ������Ӱ����ˮ����ͭ��ˮ�ļ��飬
�ʴ�Ϊ��������������Ƿ������
��4���ڼ���ʱ�������в�������Ũ���ᷴӦ��̼Ҳ��Ũ���ᷴӦ�������ɶ�����������̼��ˮ����Ӧ����ʽΪC+2H2SO4��Ũ���ᣩ$\frac{\underline{\;\;��\;\;}}{\;}$CO2 ��+2SO2��+2H2O��
�ʴ�Ϊ��C+2H2SO4��Ũ���ᣩ$\frac{\underline{\;\;��\;\;}}{\;}$CO2 ��+2SO2��+2H2O��
��5��QΪ������̼��������̼�Ͷ���������ʹ����ʯ��ˮ����ǣ�ѡ��a��b�ܶ��������Ӱ�����ж϶�����̼�Ĵ��ڣ�ѡdʱ������̼����ʯ�����գ�
��ѡC��
�ʴ�Ϊ��C��
��6��������ԭ����ͭ������ˮ������ʹ��ɫ������ͭ��ĩ����ɫ��ͬʱ�к�ɫ��ͭ�������ɣ�
�ʴ�Ϊ��D�й����ɺ�ɫ����E�й����ɰױ�����
���� ���⿼����Ũ��������ʡ�ʵ�鷽������������ۣ���Ŀ�Ѷ��еȣ�ע����������ʵ�鷽����Ƶ�ԭ�����۷�������ȷ������������ʼ����鷽���ǽ���ؼ���


 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ�� | C-C | C-H | H-H | C-O | C��0 | H-O |
| ���ܣ�kJ•mol-1�� | 348.0 | 413.0 | 436.0 | 358.0 | 1072.0 | 463.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
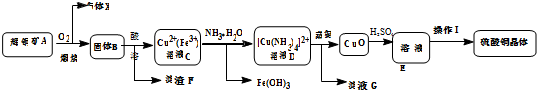
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�
������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | O3��SO2�Ľṹ���� | B�� | ��۲�����ˮ��������CS2�� | ||
| C�� | Be��OH��2�������������� | D�� | ����ͬ�����£�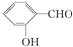 �ķе���� �ķе���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na��Al��Fe����������һ����������ˮ��Ӧ������H2�Ͷ�Ӧ�ļ� | |
| B�� | H2O2��Na202��SO2������Ư������Ư��ԭ����ͬ | |
| C�� | ����Na2C03��Һ��ͨ��CO2��Һ������ | |
| D�� | ����ʯ��ˮ����β���е�S02���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� �� �� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| �� | �� | �� | ||||||
| �� | �� | �� | �� | �� | �� | �� | ||
| �� | �� | �� |
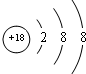
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �⻯����ȶ���H2Y��HZ | B�� | ���Ӱ뾶W3+��Z-����һ������X��W | ||
| C�� | W��X��Y��Z������������������ | D�� | �縺��Z��Y��W��X |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com