
| �¶ȣ��棩 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| CaO2ƽ���������ʣ���10-3mol��s-1�� | 7.5 | 8.2 | 9.4 | 8.0 | 7.1 | 6.7 | 5.5 |
| t/min | 0 | 10 | 20 | 30 | 40 |
| �գ�CO�� | 0.250 | 0.235 | 0.225 | 0.200 | 0.200 |
���� ��1�����ڵ����£�����������Ũ��Һ��Ͷ����ˮ�Ȼ��Ʒ������ֽⷴӦ����CaO2��HCl��
��40��֮ǰ���¶����ߣ����ʼӿ죻40��֮���¶ȼ������ߣ�˫��ˮ�ֽ⣻
��2���������⣬��Ӧ��ΪCo2+���£�N2H4�������������´���OH-��������Ϊ���ܵ��ʣ��ݴ˵ó�Co�Ļ��ϼ۽��ͣ���N�Ļ��ϼ����ߣ�ֻ��Ϊ0�ۣ�������������������ԭ��Ӧ��ʧ�����غ�شɣ�
��3����֪��Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g������H1=-25KJ/mol���٣�
3Fe2O3��s��+CO��g���T2Fe3O4��s��+CO2��g������H2=-47KJ/mol���ڣ�
Fe3O4��s��+CO��g���T3FeO��s��+CO2��g������H3=19KJ/mol���ۣ�
���ݸ�˹���ɽ�����ʽ����$\frac{��3����-��-2���ۣ�}{6}$�ã�Fe��s��+CO��g���TFe��s��+CO2��g������H��
��4����ƽ��״̬�ı�־������������ȥ�жϣ�һ���ǿ����淴Ӧ���Ƿ���ȣ����Ǹ���ֵ�Ũ�Ⱥͷ����Ƿ���ʱ��ĸı���ı䣻Ҳ����ץסδƽ��ʱ�Ǹ����������ڲ���˵���Ѿ��ﵽƽ��״̬�ˣ���������⣻
��ƽ��ʱ����v��=v����v��=k��•c��A��a•c��B��b��V��=k��•c��C��c•c��D��d����k����k��=$\frac{c��C{H}_{4}����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$=K��
��5����֪��25��ʱ��HCN�ĵ��볣��K=4.9��10-10��H2S�ĵ��볣��K1=1.3��10-7��K2=7.0��10-15��������H2S��HCN��HS-������ǿ���Ʊ����ᣬ��NaCN��Һ��ͨ��������H2S���壬��NaCN+H2S=HCN+NaHS����Qc=Ksp��MnS��ʱ��ʼ�������ɴ���������ӵ�Ũ�ȣ���ϴ�ʱ��pH���Լ�Ksp=c��Mn2+��•c��S2-�����м��㣮
��� �⣺��1�����ڵ����£�����������Ũ��Һ��Ͷ����ˮ�Ȼ��Ʒ������ֽⷴӦ����CaO2��HCl����Ӧ����ʽΪ��H2O2+CaCl2  CaO2+2HCl��
CaO2+2HCl��
�ʴ�Ϊ��H2O2+CaCl2?CaO2+2HCl��
��40��֮ǰ���¶����ߣ����ʼӿ죻40��֮���¶ȼ������ߣ�˫��ˮ�ֽ⣬Ũ���½�����Ӧ���ʼ�����
�ʴ�Ϊ��40��֮ǰ���¶����ߣ����ʼӿ죻40��֮���¶ȼ������ߣ�˫��ˮ�ֽ⣬Ũ���½�����Ӧ���ʼ�����
��2���������⣬��Ӧ��ΪCo2+���£�N2H4�������������´���OH-��������Ϊ���ܵ��ʣ��ݴ˵ó�Co�Ļ��ϼ۽��ͣ���N�Ļ��ϼ����ߣ�ֻ��Ϊ0�ۣ����������ݴ˵ó�����ˮ���ɣ�������ԭ��Ӧ�д��ڵ�ʧ�����غ��Լ�Ԫ���غ㣬�ʴ˷�Ӧ�����ӷ�Ӧ����ʽΪ��2Co2++N2H4+4OH-=2Co��+N2��+4H2O��
�ʴ�Ϊ��2Co2++N2H4+4OH-=2Co��+N2��+4H2O��
��3��Fe2O3��s��+3CO��g���T2Fe��s��+3CO2��g������H1=-25KJ/mol���٣�
3Fe2O3��s��+CO��g���T2Fe3O4��s��+CO2��g������H2=-47KJ/mol���ڣ�
Fe3O4��s��+CO��g���T3FeO��s��+CO2��g������H3=19KJ/mol���ۣ�
���ݸ�˹���ɽ�����ʽ����$\frac{��3����-��-2���ۣ�}{6}$�ã�Fe��s��+CO��g���TFe��s��+CO2��g������H=$\frac{��3����{H}_{1}-��{H}_{2}-2����{H}_{3}��}{6}$=-11KJ/mol��
�ʴ�Ϊ��FeO��s��+CO��g���TFe��s��+CO2��g����H=-11KJ/mol��
��4��a���ڻ�ѧ��Ӧǰ���������ᷢ���仯������������Ƕ�ֵ�����ܶȲ��䲻����Ϊ�ﵽ��ƽ��ı�־����a����
b������һ��������������仯�ķ�Ӧ��������ѹǿ���ٱ仯��������������ٱ仯��������Ϊ�ﵽ��ƽ��ı�־����b��ȷ��
c��v ��CH4��=v ��CO����û��ָ�����淴Ӧ��������Ϊ�ﵽ��ƽ��ı�־����c����
d��CO�ڻ�����е������������ֲ��䣬��Ũ�Ȳ��䣬������Ϊ�ﵽ��ƽ��ı�־����d��ȷ��
�ʴ�Ϊ��bd��
��35minʱ��æգ�CO��=0.2����n��CO��=4��0.2=0.8��
CO��g��+3H2��g��?CH4��g��+H2O ��g��
��ʼ��c�� 1 3 0 0
�仯 0.2 0.6 0.2 0.2
ƽ�� 0.8 2.4 0.2 0.2
K=$\frac{c��C{H}_{4}����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{0.2��0.2}{0.8��2��{4}^{3}}$=0.0036��
ƽ��ʱ����v��=v����v��=k��•c��A��a•c��B��b��v��=k��•c��C��c•c��D��d��
��k����k��=$\frac{c��C{H}_{4}����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$=K=0.0036��
�ʴ�Ϊ��0.0036��
��5����֪��25��ʱ��HCN�ĵ��볣��K=4.9��10-10��H2S�ĵ��볣��K1=1.3��10-7��K2=7.0��10-15��������H2S��HCN��HS-������ǿ���Ʊ����ᣬ��NaCN��Һ��ͨ��������H2S���壬��NaCN+H2S=HCN+NaHS����Qc=Ksp��MnS��ʱ��ʼ������������Һ��pH=a��H2S���볣����K2=7.0��10-15��HS-Ũ��Ϊ1.0��10-4mol•L-1ʱ����K2=$\frac{c��{S}^{2-}��c��{H}^{+}��}{c��H{S}^{-}��}$����7.0��10-15=$\frac{c��{S}^{2-}����1.0��1{0}^{-a}}{1.0��1{0}^{-4}}$����c��S2-��=7��10a-19mol•L-1��
����Ksp=c��Mn2+��•c��S2-��=7��10a-19mol•L-1��0.020mol•L-1=1.4��10-15�����a=5��
�ʴ�Ϊ��NaCN+H2S=HCN+NaHS��5��
���� �����Թ������Ƶ��Ʊ�Ϊ���壬������Ʊ�ԭ���ķ�������ѧƽ��ƽ���ƶ�Ӱ�����أ���ѧƽ�ⳣ�����㣬ƽ���ƶ�ԭ����Ӧ�ã���Ŀ�Ѷ��еȣ�


 ͬ������ϵ�д�
ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ѹǿ���ٸı� | B�� | ˮ���������ʵ����������������� | ||
| C�� | ������ܶȲ��ٸı� | D�� | ��Ӧ���ٽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
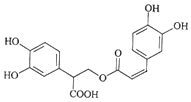
| A�� | �Ե��������ڷ����� | |
| B�� | 1mol�Ե���������ˮ��Ӧʱ�������6molBr2 | |
| C�� | �Ե�������Է���ˮ�ⷴӦ��ȡ����Ӧ��������Ӧ | |
| D�� | 1mol�Ե�������NaOH��ˮ��Һ��ȫ��Ӧʱ�������5molNaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
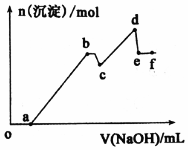 ��֪25��ʱ��Ksp[Mg��OH��2]=5.61��l0-12��Ksp[Al��OH��3]=1.3��l0-33��Al��OH��3?AlO2-+H++H2O Ka=6.31��l0-13��ij��Һ�п��ܺ��� H+��Na+��Mg2+��Al3+��Cl-��HCO3-�����ӣ������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ��������ʵ�����NaOH��Һ������仯��ͼ��ʾ�������й�˵����ȷ���ǣ�������
��֪25��ʱ��Ksp[Mg��OH��2]=5.61��l0-12��Ksp[Al��OH��3]=1.3��l0-33��Al��OH��3?AlO2-+H++H2O Ka=6.31��l0-13��ij��Һ�п��ܺ��� H+��Na+��Mg2+��Al3+��Cl-��HCO3-�����ӣ������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ��������ʵ�����NaOH��Һ������仯��ͼ��ʾ�������й�˵����ȷ���ǣ�������| A�� | b �����-Al��OH��3��d �����-A1��OH��3��Mg��OH��2��e������-NaA1O2 | |
| B�� | �������⣬��NaOH������ȫ����Mg2+��Al3+���� | |
| C�� | cd �η����ķ�ӦΪ��Mg2++2OH-=Mg��OH��2�� | |
| D�� | bc �η����ķ�ӦΪ��Al��OH��3+OH-=A1O2-+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHCO3 | B�� | NaAl��OH��2CO3 | C�� | Mg��OH��2 | D�� | BaCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��˿�ڿ�����ȼ�գ��������䣬��������ɫ���� | |
| B�� | ����������ȼ�շ�������������ɫ���� | |
| C�� | ���Թ��м���ͭ���к�ɫ�������� | |
| D�� | ����˿�ھƾ��ƵĻ��������ջ�����ս���ë����ζ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| t/min | 2 | 4 | 7 | 9 |
| n��Y��/mol | 012 | 011 | 010 | 010 |
| A�� | ��Ӧǰ2min��ƽ������v��Z��=2.0��10-5 mol•L-1•min-1 | |
| B�� | �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��v���棩��v������ | |
| C�� | ���¶��´˷�Ӧ��ƽ�ⳣ����K=1.44 | |
| D�� | ���������������䣬��ʼʱ����������0.32 mol����X��0.32mol����Y������ƽ��ʱ��n��Z��=0.024mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
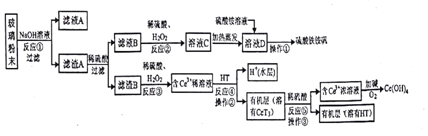
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com