
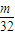 mol
mol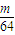 mol
mol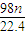 mol
mol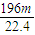 mol
mol科目:高中化学 来源: 题型:
铁是一种历史悠久、应用最广泛、用量最大的金属。有三位同学分别用铁粉
进行如下探究实验:
甲同学用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:

①步骤②中,除发生反应Fe+2HCl FeCl2+H2↑外,其他可能反应的离子方程式
为: 。
②可以验证溶液B中是否含有Fe2+的一种试剂是 (填选项序号)
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液
(2)乙同学欲用少量Fe粉与足量浓硫酸反应得到硫酸亚铁。有人认为不论常温还是加热的条件下均不可行,理由是
于是乙同学将上述方案做如下改进后可获得FeSO4·7H2O,请填写下列括号中的空白:
 (3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
(3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
.
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是一种历史悠久、应用最广泛、用量最大的金属。有三位同学分别用铁粉
进行如下探究实验:
甲同学用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:

①步骤②中,除发生反应Fe+2HCl FeCl2+H2↑外,其他可能反应的离子方程式
为: 。
②可以验证溶液B中是否含有Fe2+的一种试剂是 (填选项序号)
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液
(2)乙同学欲用少量Fe粉与足量浓硫酸反应得到硫酸亚铁。有人认为不论常温还是加热的条件下均不可行,理由是
于是乙同学将上述方案做如下改进后可获得FeSO4·7H2O,请填写下列括号中的空白:
 (3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
(3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com