
下图是酸雨形成过程,则相关说法错误的是( )
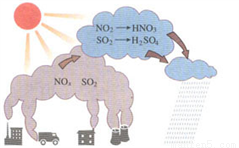
A. pH<6.5的雨水称作酸雨
B. 在酸雨形成过程中发生了氧化还原反应
C. 二氧化硫和氮氧化物被列为空气质量日报表首要污染物
D. 防止酸雨,应调整能源结构,优化能源质量,从源头上控制SO2、NOx的排放
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
下列说法错误的是
A 冰中既存在范德华力,又存在氢键
B.简单立方是非密置层三维堆积形成的, 面心立方是由密置层三维堆积形成的
C.所有共价键都有方向性, 形成氢键的三个相关原子可以不在条直线上
D.金属晶体的导电、导热性都与自由电子有关, 离子晶体在一定条件下可以导电
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三下学期第一次统测理综化学试卷(解析版) 题型:选择题
常温下,某溶液X由Fe3+、SO42-、Cu2+、Na+、CO32-、Al3+中的几种离子组成。取少量待测液滴加KSCN溶液,溶液变红;另取少量待测滴加NaOH溶液至pH=4后过滤,向滤液中继续滴加NaOH溶液至过量时又得到沉淀W和溶液Y。可能用到的数据如下表所示,下列说法正确的是
沉淀物 | Fe(OH)3 | Cu(OH)2 | Al(OH)3 |
开始沉淀的pH | 1.9 | 4.7 | 3.4 |
沉淀完全的pH | 3.2 | 6.7 | 4.7 |
A. 该温度下Ksp[Fe(OH)3]=1×10-14.6
B. W主要含有 Cu(OH)2和Al(OH)3
C. 溶液X中一定含有Cu2+、Fe3+和SO42-
D. 取溶液Y进行焰色反应,可判断溶液X中是否含有Na+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列实验设计可行的是( )
A. 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
B. 加盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
C. 用萃取的方法分离汽油和煤油
D. 用溶解、过滤的方法分离KNO3和NaCl固体混合物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )
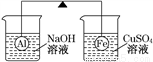
A. 铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B. 铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边下沉
C. 反应后去掉两烧杯,杠杆仍平衡
D. 右边球上出现红色,左边溶液的c(OH-)增大
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市、崇左市高三联合调研考试理科综合化学试卷(解析版) 题型:简答题
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物。有关反应的热化学方程式如下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)= H2O(l)△H=-44kJ/mol
I.写出CH3OH(l)不完全燃烧生成CO和H2O(l)的热化学方程式:_________________。
II. 工业上可用CO和H2制取甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ/mol。为研究该反应平衡时CO转化率与反应物投料比(反应物投料比=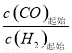 )以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
)以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
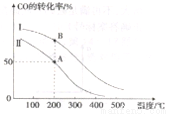
回答下列问题:
(1)反应热a____0(填“>”或“<”),判断理由是______。
(2)在其他条件相同,曲线I、II分别表示反应物投料比不同时的反应过程曲线。
①反应物投料比I_____II(填“>”或“<” 或“=”)。
②若按曲线II反应,n(CO)起始=10mol,反应物投料比=0.5,则A点的平衡常数(Ka)值为____,B点的平衡常数(Kb)值为________________。
(3)为提高CO的转化率,除了可以适当改变反应物与生成物的浓度外,还可以采取的措施有:________________、_______________。
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市、崇左市高三联合调研考试理科综合化学试卷(解析版) 题型:选择题
化学与生产生话息息相关下列有关说法错误的是
A. 硅胶可用作食品的抗氧化剂 B. 可用热碱水清洗炊具上的油渍
C. 铁表面镀锌可增强其抗腐蚀性 D. 大量燃烧化石燃料是导致雾霾天气的重要因素之一
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三实验班第六次月考理综化学试卷(解析版) 题型:填空题
工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).
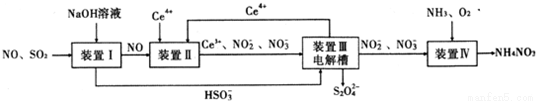
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式__________________;
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示
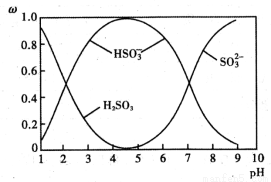
①下列说法正确的是 (填标号)。
A.pH=7时,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为 。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 。
(3)装置Ⅲ 的作用之一是再生Ce4+ ,其原理如下图所示。
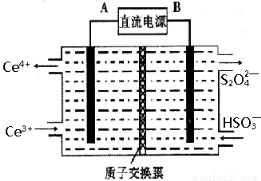
图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(4) 已知进入装置Ⅳ的溶液中NO-2的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:选择题
铝土矿的主要成分是Al2O3、SiO2和Fe2O3等。从铝土矿中提炼Al2O3的流程
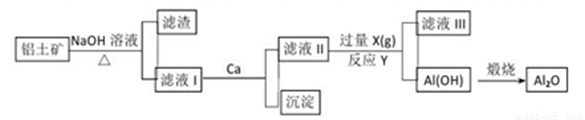
下列说法中错误的是
A. 滤液Ⅰ的主要成分是Na2SiO3、NaAlO2和NaOH
B. 滤液Ⅲ的含大量的阴离子是HCO3-
C. 反应Y的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 滤液Ⅱ中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com