
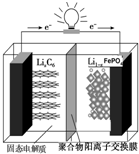
 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4分析 (1)放电时,LixC6在负极上失电子发生氧化反应;
(2)若用该电池电解精炼铜,依据串联电路中各个电极转移电子数相同,依据Cu2++2e-=Cu,计算转移电子数;
(3)用Fe2O3为阳极,石墨为阴极,NaOH溶液为电解质溶液,阳极三氧化二铁失去电子发生氧化反应结合氢氧根离子生成高铁酸根离子;
(4)依据题干给出产物,结合得失电子守恒、原子个数守恒写成方程式;
(5)①计算CuS(s)+2H+?Cu2++H2S的K值,依据一个反应的平衡常数小于10-5,则认为这个反应很难进行,进行判断;
②常温下,NaHS溶液呈碱性,说明硫氢根离子水解程度大于电离,据此解答;
依据铜离子与硫氢根离子发生反应HS-+Cu2+═CuS↓+H+解答.
解答 解:(1)放电时,LixC6在负极上失电子发生氧化反应,其负极反应为:LixC-x e-═xLi++C,故答案为:LixC-x e-═xLi++C;
(2)电解精炼铜,阴极电极反应为:Cu2++2e-=Cu,每转移2mol电子,析出64g铜,所以阴极质量增重19.2g时,转移电子数为:$\frac{19.2g}{64g/mol}$×2=0.6mol,电池与电解池为串联,所以当电解池中转移0.6mol电子,电池中转移电子数为0.6mol,锂离子带1个单位正电荷,则电池中通过聚合物隔膜的Li+数目为0.6NA,
故答案为:0.6NA;
(3)用Fe2O3为阳极,石墨为阴极,NaOH溶液为电解质溶液制备高铁酸钠(Na2FeO4),阳极三氧化二铁失去电子发生氧化反应结合氢氧根离子生成高铁酸根离子,电极反应式为:Fe2O3-6e-+10OH-═2FeO42-+5H2O,
故答案为:Fe2O3-6e-+10OH-═2FeO42-+5H2O;
(4)磷与硫酸铜溶液反应生成产物铜、磷酸,依据原子个数守恒可知还会生成硫酸,反应中铜由+2价降低到0价,P由0价升高到+5价,依据得失电子守恒,硫酸铜系数为5,磷的系数为2,依据原子个数守恒,该反应的方程式:2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4,
故答案为:2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4;
(5)①Ksp=[Cu2+][S2-];H2S:Ka1=$\frac{[{H}^{+}][H{S}^{-}]}{[{H}_{2}S]}$;Ka2=$\frac{[{H}^{+}][{{S}^{2}}^{-}]}{[H{S}^{-}]}$,
CuS(s)+2H+?Cu2++H2S,反应的K=$\frac{[C{{u}^{2}}^{+}][{H}_{2}S]}{[{H}^{+}]^{2}}$=Ksp÷Ka2÷Ka1=8.4×10-36mol2•L-2÷1.2×10-7mol•L-1÷7×10-15mol•L-1=1×10-14<10-5,所以反应难以进行;
故答案为:此反应K﹦1×10-14<10-5,所以反应难以进行;
②硫氢化钠为强电解质,完全电离生成钠离子与硫氢根离子,硫氢根离子部分发生水解,部分发生电离,所以钠离子浓度大于硫氢根离子浓度,因为常温下,NaHS溶液呈碱性说明硫氢根离子水解程度大于电离程度,所以氢氧根离子浓度大于硫离子浓度,加之水电离生成氢离子,所以氢离子浓度大于硫离子浓度,所以离子浓度大小顺序为:c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Na+),
向溶液中加入硫酸铜后发生反应:HS-+Cu2+CuS↓+H+,生成氢离子,所以溶液pH<7,
故答案为:c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Na+);<.
点评 本题综合考查了原电池、电解池工作原理及相关计算,弱电解质电离平衡、沉淀溶解平衡等知识,为高频考点,侧重于学生的分析能力和计算能力的考查,熟悉原电池、电解池工作原理及各个电极发生反应、明确化学平衡常数的表达式是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
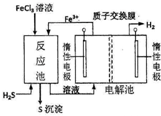 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )| A. | 左槽中发生的反应是:2Cl--2e-═Cl2↑ | |
| B. | 右槽中的反应式:2H++2 e-═H2↑ | |
| C. | H+从电解池左槽迁移到右槽 | |
| D. | FeCl3溶液可以循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | BaO2量不变 | C. | 氧气压强不变 | D. | BaO量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中NO与O2的体积之比为4:1 | |
| B. | 水吸收后的剩余气体是O2,且c=$\frac{a}{6}$ | |
| C. | 取m g AgNO3溶于水再加足量盐酸可生成沉淀$\frac{2a}{3×22.4}$×143.5g | |
| D. | 水吸收后所得溶液中HNO3的物质的量浓度为$\frac{b}{108}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应 3A+B 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示:
(1)T0对应的反应速率v正__________v逆。(填“>”“<”或“=”);
(2)此反应的正反应为___________热反应。(填“吸”或“放”);
(3)X、Y两点A物质正反应速率的大小关系是Y___________X;(填“>”“<”或“=”);
(4)若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为____________mol;若Y点时所耗时间为2min,则B物质的反应速率为__________mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com