
已知某溶液中只存在OH-、Cl-、N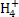 、H+四种离子,下列说法不正确的是( )
、H+四种离子,下列说法不正确的是( )
A.若溶液中c(N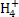 )=c(Cl-),则该溶液一定显中性
)=c(Cl-),则该溶液一定显中性
B.若溶液中c(N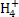 )>c(Cl-)>c(OH-)>c(H+),则溶液中一定含有NH4Cl和NH3·H2O
)>c(Cl-)>c(OH-)>c(H+),则溶液中一定含有NH4Cl和NH3·H2O
C.若溶液中c(Cl-)>c(N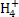 )>c(H+)>c(OH-),则溶液中可能含有NH4Cl或可能含有NH4Cl和HCl
)>c(H+)>c(OH-),则溶液中可能含有NH4Cl或可能含有NH4Cl和HCl
D.若溶液中c(Cl-)>c(H+)>c(N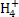 )>c(OH-),则溶液中含有大量的NH4Cl和少量的HCl
)>c(OH-),则溶液中含有大量的NH4Cl和少量的HCl
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
下列说法中错误的是( )
A.在Na2S溶液中滴入酚酞试液,呈红色 B.硫酸铵溶液显酸性
C.一切钾盐、钠盐、硝酸盐都不发生水解 D.醋酸盐溶于水能发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学清洗银镜实验后试管内壁上的银并探究其中的反应原理,进行下列实验。
(1)用稀硝酸可以清洗试管内壁上的银,反应的化学方程式为______________。
(2)为消除(1)中所产生的污染问题,改为如下实验。
| 实验编号 | 操作 | 现象 |
| Ⅰ |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;反应停止后,试管内壁上的银全部溶解,得到澄清液体a |
①该同学由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能性。他的操作及现象是:取实验Ⅰ所得液体于试管中,______________;
②经查阅资料,发现:实验Ⅰ中银镜溶解后经一系列反应,最后产物为Ag,但是因为颗粒很小(直径在1~100 nm 间)分散在液体中,肉眼无法识别。该同学设计实验,证实了a中存在直径在1~100 nm间的颗粒。他的操作及现象是:________________;
③写出实验Ⅰ的化学方程式:______________。
(3)进一步探究银的化合物在H2O2分解反应中的作用,进行如下实验。
| 实验 编号 | 操作 | 现象 |
| Ⅱ |
| 振荡,溶液无明显现象 |
| Ⅲ |
| 剧烈反应,产生大量无色气体,同时在试管底部仍有少量黑色固体 |
①实验Ⅱ的目的是____________;
根据实验Ⅲ的现象提出假设:
假设1:Ag2O在H2O2分解反应中作氧化剂;
假设2:Ag2O在H2O2分解反应中作催化剂。
②若假设1成立,请写出该反应的化学方程式:______________;
③结合所给试剂,请设计一个简单的实验证明假设1,并将表格填写完整。
可选试剂:1 mol·L-1盐酸、0.1 mol·L-1氨水、1 mol·L-1 NaOH溶液
| 实验步骤和操作 | 实验现象及结论 |
| 取3 mL 10% H2O2在试管中,加入少量Ag2O,充分反应后,__________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2====2X+2H2O,下列说法中正确的是( )
A.X的化学式为AgS
B.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂
D.每生成1 mol X,反应转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
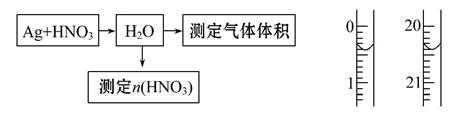
(1)测定硝酸的物质的量:
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用
0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B装置中生成硝酸的物质的量为 ,则Ag与浓硝酸反应过程中生成的NO2的物质的量为 。
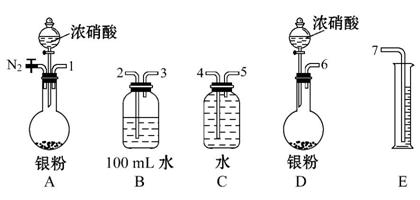
(2)测定NO的体积:
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是 (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置 (选填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析:
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中 (选填“有”或“没有”)NO产生,作此判断的依据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)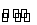 cC(g)+dD(g),取a mol A和b mol B置于V L容器中,1 min后,测得容器内A的浓度为x mol·L-1。
cC(g)+dD(g),取a mol A和b mol B置于V L容器中,1 min后,测得容器内A的浓度为x mol·L-1。
(1)此时C的浓度为 _________mol·L-1。
(2)D的物质 的量为_________mol。
的量为_________mol。
(3)这段时间内反应的平均速率若以物质A的浓度变化来表示,应为__________。
(4)B的转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是( )
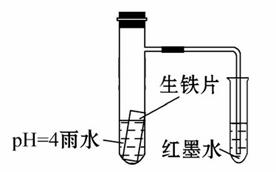
A.生铁片中的碳是原 电池的阳极,发生还原反应
电池的阳极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳极反应式为:O2+2H2O+4e-====4OH-
D.具支试管中溶液pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢。在如图所示装置中,观察到图(a)装置铜电极上产生大量的无色气泡,而图(b)装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )
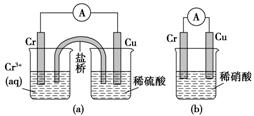
A.图(a)为原电池装置,Cu电极上产生的是O2
B.图(b)装置中Cu电极上发生的电极反应式为Cu-2e-===Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com