
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
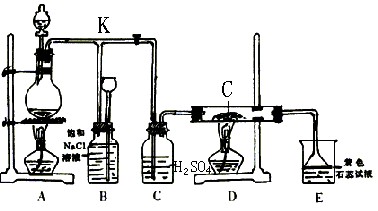
(1)A为氯气发生装置,写出反应的化学方程式_____________________________________。;
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(气),试写出D装置中反应的化学方程式___________________________________;装置C的作用是______________________。
(3)E处石蕊试液的现象是_______________________________________________。其原因是______________________________________________________________________。
(4)若将E处溶液改为石灰水,反应过程的现象是___________________
A.有白色沉淀生成 B.没有白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是_______________________,B的作用是______________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.

 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通 入淀粉KI溶液 |
溶液最初变成 蓝 蓝 色 |
Cl2+2I-=2Cl-+I2 Cl2+2I-=2Cl-+I2 (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=10HCl+2HIO3 5Cl2+I2+6H2O=10HCl+2HIO3 (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
海水蒸发→粗盐水、重结晶精盐

(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式____________________________________。
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________。
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。_____________________。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的。
溶解时:______________________________________________________;
过滤时:______________________________________________________;
蒸发时:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)江苏省拥有很长的海岸线,具有丰富的海洋资源,因此盐化工是本省的一个重要产业。从盐卤初步得到的光卤石(KCl·MgCl2·6H2O)晶体中,还含有约8%的NaCl。
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
并设计出下面的实验流程:
根据他们提供的数据和实验回答下列问题:
问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用
的方法进一步提纯。操作步骤①中趁热过滤的原因是:
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2·6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别
是 (填写仪器的符号),需要加热的仪器是 (同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com