
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 与相同浓度盐酸反应的快慢:Na2CO3>NaHCO3 | |
| C. | 106gNa2CO3和84gNaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3 | |
| D. | Na2CO3 和NaHCO3均可与澄清石灰水反应 |
分析 A、NaHCO3不稳定,加热易分解;
B、相同条件下NaHCO3比Na2CO3反应放出气体剧烈;
C、等物质的量的Na2CO3和NaHCO3分别与过量盐酸反应,放出CO2一样多;
D、Na2CO3较NaHCO3都与澄清石灰水反应生成沉淀;
解答 解:A、NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,Na2CO3稳定,加热不分解,所以热稳定性:Na2CO3>NaHCO3,故A错误;
B、Na2CO3和盐酸反应先生成NaHCO3,NaHCO3再和盐酸反应生成CO2,所以相同浓度盐酸反应的快慢:Na2CO3<NaHCO3,故B错误;
C、106gNa2CO3和84gNaHCO3的物质的量都为1mol,都与盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,等物质的量的Na2CO3和NaHCO3分别与过量盐酸反应,放出CO2质量相等,故C错误;
D、碳酸钠和碳酸氢钠分别和氢氧化钙反应的方程式如下:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH、NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH,均可产生沉淀,故D正确;
故选D.
点评 本题主要考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 氧化亚铁与稀盐酸反应:FeO+3H+═Fe3++H2O | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2 Cl- | |
| D. | 金属钠与水反应:2Na+2H2O═2 Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
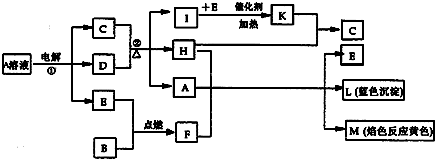
 ,所含化学键的类型离子键和共价键;
,所含化学键的类型离子键和共价键;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ①⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相等 | B. | 原子数相等 | C. | 分子数相等 | D. | 质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
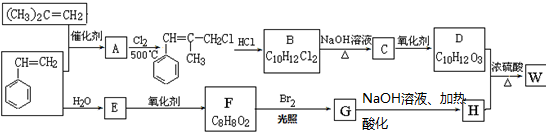 ,
,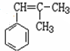 ; F的结构简式为
; F的结构简式为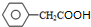 ;
;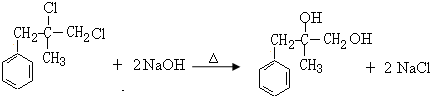 ;D+H→W的化学方程式为
;D+H→W的化学方程式为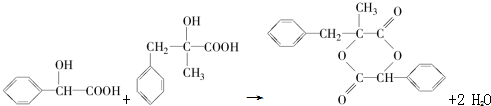 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com