
| A. | CO、H2S的转化率之比为1:1 | |
| B. | 达平衡后H2S的体积分数为29.4% | |
| C. | 升高温度,COS浓度减小,表明该反应是吸热反应 | |
| D. | 恒温下向平衡体系中再加入CO、H2S、COS、H2各1 mol,平衡不移动 |
分析 反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,设反应前H2S物质的量为n,则:
CO(g)+H2S(g)?COS(g)+H2(g)
起始(mol):10 n 0 0
变化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
该温度下该反应的K=0.1,利用物质的量代替浓度代入平衡常数表达式计算出n,根据计算结构及化学平衡的影响因素进行判断.
解答 解:反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,设反应前H2S物质的量为nmol,则:
CO(g)+H2S(g)?COS(g)+H2(g)
起始(mol):10 n 0 0
变化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
该温度下该反应的K=0.1,设容器容积为V,
则平衡常数K=$\frac{\frac{2}{V}×\frac{2}{V}}{\frac{8}{V}×\frac{(n-2)}{V}}$=0.1,解得:n=7,即反应前硫化氢的物质的量为7mol,
A.由于反应前CO、H2S的物质的量分别为10mol、7mol,而二者化学计量数相等,反应消耗的物质的量相等,所以二者的转化率一定不相等,故A错误;
B.该反应前后气体的体积相等,则反应后气体的总物质的量不变,仍然为10mol+7mol=17mol,平衡后硫化氢的物质的量为(7-2)mol=5mol,相同条件下气体的体积分数=物质的量分数=$\frac{5mol}{17mol}$×100%≈29.4%,故B正确;
C.升高温度,COS浓度减小,说明平衡向着逆向移动,则该反应的正反应为放热反应,故C错误;
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1 mol,则此时该反应的浓度商Qc=$\frac{\frac{8+1}{V}×\frac{5+1}{V}}{\frac{2+1}{V}×\frac{2+1}{V}}$=6>K=0.1,说明平衡会向着逆向移动,故D错误;
故选B.
点评 本题考查了化学平衡的计算,题目难度中等,正确计算硫化氢的初始物质的量为解答关键,注意掌握三段式在化学平衡计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| B. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-2akJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
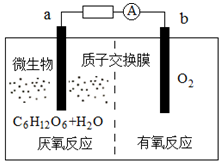 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )| A. | b极为正极,发生氧化反应 | |
| B. | 外电路中电子的移动方向为:b→a | |
| C. | 质子通过交换膜从b极区移向a极区 | |
| D. | 电池总反应为C6H12O6+6O2=6CO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
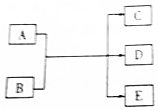 一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体. ,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.
,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
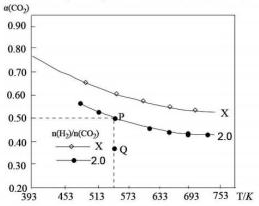 在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 若起始时,CO2、H2、浓度分分别为0.5mol/L和1.0mol/L,则可得P点,对应温度的平衡常数的值为512 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,再次平衡后a(CO2)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
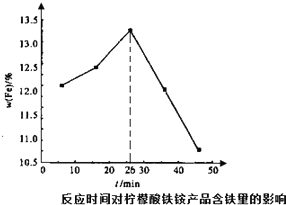 柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下: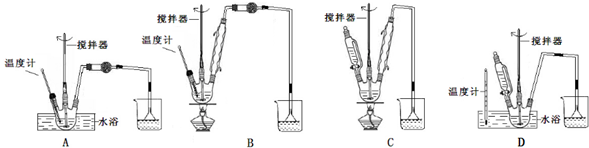
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com