
【题目】在25 ℃时,将1.0L c molL-1CH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入少量CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是
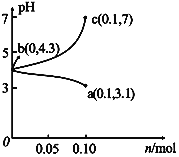
A. 水的电离程度:c>b>a
B. a点对应的混合溶液中,c(CH3COOH)>c(Na+ )>c(OH-)
C. 当混合溶液呈中性时,c(Na+ )=c(CH3COO-)>c(H+) =c(OH-)
D. 该温度下,醋酸的电离平衡常数![]()
【答案】D
【解析】A项,由图可得,25℃时c点pH=7,所以c点水电离的c(H+)水=c(OH-)水=10-7mol/L,b点pH=4.3,所以b点溶液中c(H+)=10-4.3 mol/L,则由水电离出的c(H+)水=c(OH-)水=10-(14-4.3)mol/L=10-9.7mol/L,a点pH=3.1,所以a点溶液中c(H+)=10-3.1 mol/L,则由水电离出的c(H+)水=c(OH-)水=10-(14-3.1)mol/L=10-10.9mol/L,因此水的电离程度:c>b>a,故A正确;B项,b点时溶液呈酸性,说明加入0.1molNaOH固体后CH3COOH有剩余,c(Na+)=0.1mol/L,混合前CH3COOH溶液浓度c应比0.1mol/L大,a点时又加入0.1molCH3COOH,因为CH3COOH电离程度很小,所以此时溶液中的c(CH3COOH)一定大于c(Na+),又根据前面的分析a点c(OH-)=10-10.9mol/L,所以a点对应的混合溶液中,c(CH3COOH)>c(Na+)>c(OH-),故B正确;C项,由题意混合溶液中阳离子有Na+和H+,阴离子有CH3COO-和OH-,根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),25℃当混合溶液呈中性时,c(H+)=c(OH-)=10-7mol/L,则c(Na+)=c(CH3COO-),由已知及图像可得c(Na+)=0.2mol/L,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故C正确;D项,由前面的分析并结合图像可得,25℃当混合溶液呈中性时,c(H+)=10-7mol/L,c(CH3COO-)=0.2mol/L,c(CH3COOH)=(c+0.1-0.2)mol/L=(c-0.1)mol/L,所以该温度下,醋酸的电离平衡常数Ka=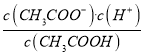 =
=![]() ,故D错误。
,故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室中欲分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作流程图 ( )

A. ①蒸馏 ②过滤 ③分液 B. ①分液 ②蒸馏 ③结晶
C. ①蒸馏 ②分液 ③分液 D. ①分液 ②蒸馏 ③蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 稀硫酸溶液与氢氧化钡溶液恰好中和: Ba2++OH﹣+H++SO42﹣=BaSO4↓+H2O
B. 金属钠投入硫酸镁溶液中: 2Na+2H2O +Mg2+=2Na++H2↑+Mg(OH)2↓
C. 碳酸钠溶液中通入过量氯气: CO32﹣+Cl2=CO2↑+Cl-+ClO-
D. 实验室用 MnO2 和浓盐酸制取 Cl2: MnO2+4HCl(浓) ![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时, H3A 水溶液(一种酸溶液)中含 A 的各种粒子的分布分数(平衡时某种粒子的浓度占各种粒子浓度之和的分数(α)与 pH 的关系如图所示。下列叙述正确的是( )
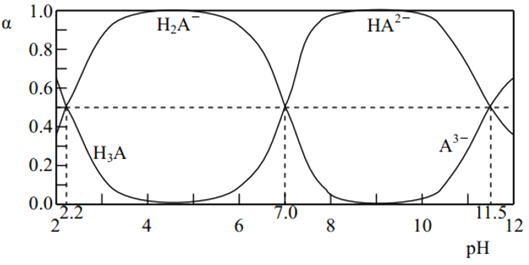
A. 根据图,可得 Ka1(H3A )≈10-7
B. 将等物质的量的 NaH2A 和 Na2HA 混合物溶于水,所得的溶液中 α(H2Aˉ)=α(HA2-)
C. 以酚酞为指示剂(变色范围 pH 8.2~10.0),将 NaOH 溶液逐滴加入到 H3A 溶液中,当溶液由无色变为浅红色时停止滴加,则生成 NaH2A
D. 在上述含 A 的各种粒子的体系中,若 c(H2Aˉ)+5c(A3ˉ)+c(OHˉ)=c(H+),则溶液pH为11.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质变化的比较,不正确的是( )
A.还原性强弱:F﹣>Cl﹣>I﹣
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.稳定性强弱:HF>HCl>HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物,其结构简式如图: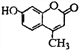 下列说法不正确的是
下列说法不正确的是
A. 羟甲香豆素分子式为C10H8O3
B. 1mol羟甲香豆素最多可以与5mol H2发生加成
C. 1mol羟甲香豆素溶于足量NaOH溶液,最多可消耗3mol NaOH
D. 羟甲香豆素分子中含有酯基、酚羟基、碳碳双键,属于芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇可由乙烯气相直接水合法或间接水合法生产,一些转化如图。

某些物质的有关数据如下表:
熔点/℃ | 沸点/℃ | 水溶性 | |
乙醇 | -114.1 | 78.3 | 易溶 |
乙醛 | -121 | 20.8 | 易溶 |
乙酸乙酯 | -83 | 77.0 | 难溶 |
回答以下问题:
(1)间接水合法中的转化③:乙烯与浓硫酸反应生成硫酸氢乙酯(CH3CH2—OSO3H)的有机反应类型是_____________,转化④的化学方程式是__________________;
(2)蘸有B的玻璃棒遇到氮的最简单氢化物气体会冒白烟,反应的化学方程式为________,转化⑤的化学方程式为______________________________;
(3)将一质量为w的铜丝灼烧变黑后,迅速插入乙醇中,变黑的铜丝恢复红色。
①使铜丝恢复红色的反应的化学方程式为________________________;
②若要证明铜丝起催化作用,还需要进行的操作是_______________;
(4)已知:CH3CHO + NaHSO3 →![]() ↓(α-羟基乙磺酸钠),如上所得乙醛可用如下方式提纯:
↓(α-羟基乙磺酸钠),如上所得乙醛可用如下方式提纯:
![]()
①α-羟基乙磺酸钠的晶体类型为___________________。
②分离操作A的名称是________________;
③某同学设计分离操作B的装置(夹持和加热装置已略去)如图所示。冷凝管中的液体应从_____口进。(填“D”或“E”)

下列有关操作与装置的分析,正确的是_____。(填字母,多选反扣)
A.烧杯中应装冰水
B.冷凝管应通温水
C.图示装置可用于除去乙酸乙酯中混有的乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S为二元弱酸。20 ℃时,向0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A. 通入HCl气体之前: c(S2-)>c(HS-)>c(OH-)>c(H+)
B. c(HS-)=c(S2-)的碱性溶液中: c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
C. pH=7的溶液中: c(Cl-)=c(HS-)+2c(H2S)
D. c(Cl-)=0.100 mol·L-1的溶液中: c(OH-)-c(H+)=c(H2S)-c(S2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com