
| A、往明矾溶液中逐滴加入氢氧化钡溶液至SO42-恰好完全沉淀Al3++2 SO42-+2 Ba2++4 OH-=2 BaSO4↓+AlO2-+2 H2O |
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C、用稀HNO3溶液溶解FeS固体:FeS+2H+=Fe2++H2S↑ |
| D、AgNO3溶液中加入过量的氨水:Ag++NH3?H2O=AgOH↓+NH4+ |


科目:高中化学 来源: 题型:
| A、标准状况下,1mol H2O和1mol H2的体积都约为22.4L |
| B、1molNa2CO3 中Na+ 的物质的量为1mol |
| C、1mol某气体的体积为22.4L |
| D、标准状况下,1g H2和 11.2LO2的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y的气态简单氢化物的热稳定性比W的强 |
| B、X的最高价氧化物对应水化物的酸性比W的弱 |
| C、Y分别与Z、W形成的化合物均为碱性氧化物 |
| D、原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:
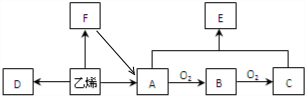
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,32gO2占有的体积约为22.4L |
| B、氢气的摩尔质量是2g |
| C、在标准状况下,22.4L水的质量为18g |
| D、1molH2O的质量是18g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3、Na2CO3分别与盐酸反应 |
| B、CuO分别与稀硫酸、稀盐酸、稀硝酸反应 |
| C、H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 |
| D、Na分别与水、稀盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烯的结构简式:C3H6 |
B、3-甲基-1-丁烯的结构简式: |
C、HOCH2COOH缩聚物的结构简式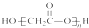 |
D、苯甲醛: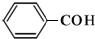 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.
X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com