
如图所示的装置分别进行如下实验,各组物质反应后,溶液的导电性比反应前明显增强的是( )
A.向亚硫酸钠溶液中通入氯气:Na2SO3+Cl2+H2O===Na2SO4
+2HCl
B.向硝酸银溶液中通入少量氯化氢:AgNO3+HCl===AgCl↓+HNO3
C.向硫化氢饱和溶液中通入少量氧气:2H2S+O2===2H2O+2S↓
D.向NaOH溶液中通入少量氯气:2NaOH+Cl2===NaCl+NaClO+H2O
科目:高中化学 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中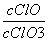 =
=
B.参加反应的氯气的物质的量等于 a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围: a mol≤ne≤
a mol≤ne≤ a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于原子结构、元素性质的说法正确的是
A.随着原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小
B.若两种不同核素具有相同的中子数,则二者一定不属于同种元素
C.若两种元素的原子的最外层电子数相同,则元素的最高正价一定相同
D.电子层结构相同的微粒,其化学性质一定相似
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、鱼池增氧等。过氧化钙在常温下是白色或淡黄色粉末,易溶于酸,难溶于水、乙醇等溶剂。某实验小组在实验室用钙盐制取CaO2·8H2O(该反应为放热反应)。
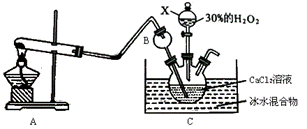
Ⅰ、第一部分:
(1)仪器B的名称为____________,作用是______________________。
(2)A为实验室制取氨气的装置,写出A中发生反应的化学方程式_______________。
(3)制取CaO2·8H2O一般在0℃~5℃的低温下进行,原因是________________;写出生成CaO2·8H2O的化学方程式________________________________________________。
Ⅱ、第二部分:
欲测定产品中CaO2的含量,实验步骤是:已知:I2 + 2S2O32- = 2I- + S4O62-
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(4)判断此滴定实验达到终点的方法是: 。
(5)CaO2的质量分数为 (用字母表示);
(6)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“无影响”、“偏低”或“偏高”)。[来源:Z|xx|k.Com]
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 天然气 | 硫酸 | 醋酸 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 硫酸钡 | 醋酸 | 三氧化硫 |
| C | 胆矾 | 石灰水 | 苛性钾 | 水 | 碳酸钙 |
| D | 硫酸 | 青铜 | 氯化钠 | 氢氧化铁 | 氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四种化合物,它们分别由K+、Ba2+、SO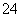 、CO
、CO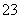 、OH-、SO
、OH-、SO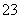 离子中的两种组成,它们具有下列性质:
离子中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;②B不溶于水但溶于盐酸并放出无刺激性气味的气体;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出的气体E可使溴水褪色。
(1)写出化学式:A.________、B.________、C.________、D.________、E.________。
(2)写出离子方程式:
B+盐酸___________________________________________________________;
C+硫酸___________________________________________________________;
D+硫酸___________________________________________________________;
E+溴水____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应
D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl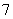 和AlCl
和AlCl 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,______________(填“能”或“ 不能”)说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有两种饱和一元醇的混合物18.8 g,与13.8 g Na充分反应,生成的H2在标准状态下的体积为5.6 L,这两种醇分子中相差一个碳原子。则这两种醇是( )
A.甲醇和乙醇 B.乙醇和1丙醇
C.2丙醇和1丁醇 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com