
| A. | 硫酸铝铵中Al3+的水解程度比明矾中Al3+的水解程度大 | |
| B. | 该物质的水溶液中Na+、K+、Cl-、S2-都可大量共存 | |
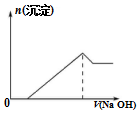
| C. | 向该物质的溶液中滴加同浓度的NaOH溶液的体积与生成沉淀的关系如图所示 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,使SO42-恰好完全沉淀的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
分析 A.硫酸铝铵溶液中铵根离子水解显酸性抑制铝离子的水解;
B.溶液中铝离子和硫离子发生双水解生成氢氧化铝和硫化氢;
C.向该物质的溶液中滴加同浓度的NaOH溶液,先生成氢氧化铝沉淀,再和铵根离子结合生成一水合氨,沉淀量不变,继续滴加氢氧化铝沉淀溶解;
D.向该物质的溶液中滴加Ba(OH)2溶液,使SO42-恰好完全沉淀二者恰好按照NH4Al(SO4)2和Ba(OH)2,物质的量之比为1:1,据此书写离子方程式.
解答 解:A.硫酸铝铵溶液中铵根离子水解显酸性抑制铝离子的水解,明矾溶液中铝离子水解显酸性,硫酸铝铵中Al3+的水解程度比明矾中Al3+的水解程度小,故A错误;
B.该物质的水溶液中S2-和铝离子发生双水解生成氢氧化铝和硫化氢,不可大量共存,故B错误;
C.向该物质的溶液中滴加同浓度的NaOH溶液,先生成氢氧化铝沉淀,再和铵根离子结合生成一水合氨,沉淀量不变,继续滴加氢氧化铝沉淀溶解,曲线变化为先沉淀,再出现平台,最后沉淀溶解,故C错误;
D.向该物质的溶液中滴加Ba(OH)2溶液,使SO42-恰好完全沉淀二者恰好按照NH4Al(SO4)2和Ba(OH)2,物质的量之比为1:1,离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O,故D正确;
故选D.
点评 本题考查了盐类水解、离子性质、离子反应定量关系、离子方程式书写、图象的变化趋势判断,掌握基础是解题关键,题目难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
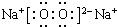 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质是有机物 | B. | 该分子中含有9个σ键和10个π键 | ||
| C. | 该分子可发生加成反应 | D. | 该分子中所有原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na>Mg>Al | B. | 非金属性:Cl>S>P>Si | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性:HClO>H2SO3>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲苯(
甲苯( 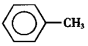 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( 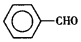 )、苯甲酸(
)、苯甲酸( 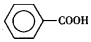 )等产品.表列出了有关物质的部分物理性质,请回答:
)等产品.表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
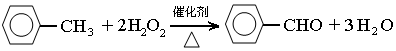
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
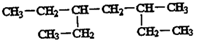 的下列说法中,不正确的是( )
的下列说法中,不正确的是( )| A. | 该有机物属于烷烃 | |
| B. | 该有机物与3-甲基-5-乙基辛烷互为同系物 | |
| C. | 该有机物与2,5-二甲基一3-乙基己烷互为同分异构体 | |
| D. | 该有机物命名时,主链上的碳原子数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
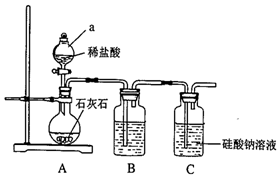 某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如图:
某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 灼烧白色粉末,火焰呈黄色 | 证明原粉末中有Na+,无K+ |
| B | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 | 证明该Fe(NO3)2试样已经变质 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br-还原性强于Cl- |
| D | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 证明溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com