
| A、向AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| B、往CaCl2溶液通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
| C、碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
| D、向Ba(OH)2溶液中加入少量的NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ |
| B、小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
| C、“84”消毒液(主要成分为NaClO)露置在空气中变质:2ClO-+CO2+H2O═CO32-+2HClO |
| D、在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O═2Fe3++Cl-+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、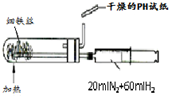 合成氨并检验氨的生成 |
B、 碘的CCl4溶液中分离I2并回收CCl4 |
C、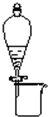 分离CH3CH2OH和CH3COOC2H5混合液 |
D、 制备Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?N2O4的△H<0 |
| B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| D | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| A、MgSO4,CuSO4 |
| B、AgNO3,Pb(NO3)2 |
| C、FeSO4,Al2 (SO4)3 |
| D、CuSO4,AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 石棉矿是天然纤维状硅酸盐类矿物的总称,可分为蛇纹石石棉矿(又称温石棉矿)和闪石类石棉矿两大类.蛇纹石石棉矿具有优良的性能,在工业中应用广泛,在国防和航天工业中亦有许多用途.
石棉矿是天然纤维状硅酸盐类矿物的总称,可分为蛇纹石石棉矿(又称温石棉矿)和闪石类石棉矿两大类.蛇纹石石棉矿具有优良的性能,在工业中应用广泛,在国防和航天工业中亦有许多用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com