
| n |
| V |
| 36g |
| 136g |
| 9 |
| 34 |
| 58.5g | ||
|
| ||
| m |
| ρ |
| 221g |
| 1200g/L |
| 1mol |
| 0.184L |


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
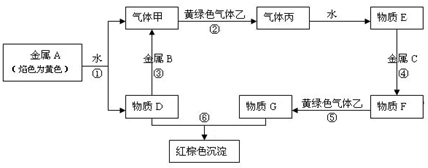
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验目的 | |
| A | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠中含有醛基 |
| B | 向苯酚的饱和溶液中滴加稀溴水 | 制备三溴苯酚 |
| C | 向酒精和醋酸的混合液中加入金属钠 | 确定酒精中混有醋酸 |
| D | 将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的溴离子 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
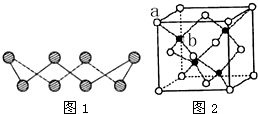 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
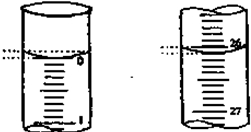
| 滴定次数 | 待测氢氧化钠 的体积/ml | 0.1000mol?L-1盐酸的体积/ml | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/ml | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 34.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生用物质的量的浓度为a mol/L的标准NaOH去测定V mL HCl溶液的物质的量浓度.用甲基橙作指示剂. 回答下列问题:
某学生用物质的量的浓度为a mol/L的标准NaOH去测定V mL HCl溶液的物质的量浓度.用甲基橙作指示剂. 回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制Fe(OH)2时应将汲有NaOH溶液的胶头滴管伸入FeSO4溶液液面下,缓缓挤出碱液 |
| B、镁铝合金的硬度和熔点都比纯铝和纯镁大 |
| C、结晶形和无定形二氧化硅统称硅石 |
| D、常温下,铝能和空气里的氧气反应生成一层致密的氧化膜,从而常温耐腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com