
下列有关电解质溶液的叙述正确的是
A.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,则滤液中: c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2c(CO32-)
B.40℃时,在氨水体系中不断通入CO2,随着CO2的通入,不断增大
C.室温下,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入0.05molCaO,所得溶液中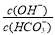 增大
增大
D.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝,关于核素 Lv的叙述错误的是
Lv的叙述错误的是
A.原子序数为116 B.中子数为177
C.核外电子数为116 D.该元素的相对原子质量为293
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高二下第四次半月考化学试卷(解析版) 题型:选择题
原理Cr2O72-+CH3CH2OH+H++H2O→[Cr(H2O)6]3++CH3COOH(未配平)可用于检测司机是否酒后驾驶,下列说法正确的是( )
A.消耗1molCH3CH2OH时转移电子的物质的量为4mol
B.1mol/LCH3COOH溶液中含有σ键的数目为7NA个
C.H2F+、NH2-、H2S、CH4均与H2O互为等电子体
D.在配合物[Cr(H2O)6]3+中,H、O原子与中心离子Cr3+形成配位键
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三5月月考理综化学试卷(解析版) 题型:选择题
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是
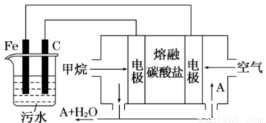
A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32—向空气一极移动
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月高考模拟理综化学试卷(解析版) 题型:填空题
【化学―选修 3 物质结构与性质】
氮族元素(Nitrogen group)是元素周期表VA 族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和Uup共计六种。
(1)氮族元素的外围电子排布式的通式为 ;基态磷原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 。
(2)PH3分子的VSEPR模型为______________,键角NH3 H2O(填“>”、“<”或“=”)。
(3)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子中氮的杂化方式为 。
(4)从化合物NF3和NH3的结构与性质关系比较,回答它们两者如下性质差异原因:
①NF3的沸点为-129℃,而NH3的沸点为-33℃,其原因是 。
②NH3易与Cu2+反应,而NF3却不能,其原因是 。
(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层,磷化硼晶体的晶胞结构与金刚石类似,磷原子作面心立方最密堆积,则硼原子的配位数为________;已知磷化硼的晶胞边长a = 478 pm,计算晶体中硼原子和磷原子的核间距(dB-P)=__________pm(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是

A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中都有可逆反应发生
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三考训练四理综化学试卷(解析版) 题型:选择题
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是 ( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O HClO + OHˉ的水解常数K≈10ˉ7.6
HClO + OHˉ的水解常数K≈10ˉ7.6
D.向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F—)>c(H+)>c(HClO)>c(OH—)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下课后作业乙烯化学试卷(解析版) 题型:选择题
由乙烯推测丙烯(CH2=CH-CH3)与溴水反应时,下列反应产物正确的是 ( )
A.CH2Br-CH2-CH2Br B.CH3-CBr2-CH3
C.CH3-CH2-CHBr2 D.CH3-CHBr-CH2Br
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期中化学试卷(解析版) 题型:填空题
现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | 最外层电子数是电子层数的3倍 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是__________;X的一种氢化物燃烧时火焰温度高,可以焊接金属,则该氢化物的结构式为 ;实验室制取该气体的化学方程式是 。
(2)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol·L-1 NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为 g。
(3)元素Y与氢元素形成一种离子YH,写出该微粒的电子式____________(用元素符号表示)。实验室检验该微粒的方法是: 。
(4)T元素在周期表的位置: ,其简单阴离子的结构示意图: , 证明该粒子的还原性比Z— 强的离子方程式是 。硒(Se)是人体必需的微量元素,与T在同一主族,Se原子比T原子多一个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物的化学式为________。
(5)元素Z与氢氧化钠溶液反应的化学方程式为 ,其生成的含氧酸盐的电子式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com