
| A. | Co2O3+6HCl=2CoCl2+Cl2↑+3H2O中,氧化剂和还原剂物质的量之比为1:6 | |
| B. | 5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O中,氧化产物和还原产物物质的量之比为5:1 | |
| C. | 3S8+24KOH=8K2SO3+4K2S4+12H2O中,被氧化和被还原的S8物质的量之比为2:1 | |
| D. | 3(NH4)2SO4=3SO2+N2+6H2O+4NH3中,反应中发生氧化反应和未发生氧化反应的氮元素物质的量之比为2:1 |
分析 A.Co元素的化合价由+3价降低为+2价,Cl元素的化合价由-1价升高到0价;
B.KI中I元素的化合价由-1价升高0,KIO3中I元素的化合价由+5价降低为0,
C.3S8中生成8K2SO3,S化合价升高被氧化,生成4K2S4,S化合价降低被还原;
D.3(NH4)2SO4=3SO2↑+N2↑+4NH3↑+6H2O反应中,N元素的化合价由-3价升高为0,S元素的化合价由+6价降低为+4;
解答 解:A.Co元素化合价升高,则氧化剂为Co2O3,Cl元素的部分化合价由-1价升高到0价,则还原剂为2HCl,氧化剂和还原剂物质的量之比为1:2,故A错误;
B.5KI+KIO3+3H2SO4═3I2+3K2SO4+3H2O中,KI中I元素的化合价由-1价升高0,KIO3中I元素的化合价由+5价降低为0,含元素化合价降低的物质为氧化剂,则氧化剂为KIO3,由I原子守恒可知,对应还原产物I2的物质的量为0.5mol,含元素化合价升高的物质为还原剂,则还原剂为KI,由I原子守恒可知,对应氧化产物I2的物质的量为2.5mol,所以氧化产物和还原产物的物质的量之比是2.5mol:0.5mol=5:1,故B正确;
C.3S8中的S化合价既升高又降低,生成8K2SO3,S化合价升高被氧化,生成4K2S4,S化合价降低被还原,则根据S原子守恒,则被氧化和被还原的S8物质的量之比为1:2,故C错误;
D.反应中6molN参加反应,被氧化的N为2mol,未被氧化的N为4mol,所以反应中发生氧化反应和未发生氧化反应的氮元素物质的量之比为1:2,故D错误;
故选B.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤ | B. | ②④ | C. | ①② | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (NH3)=0.3 mol•L-1•min-1 | B. | v (H2)=0.3mol•L-1•min-1 | ||
| C. | v(N2)=0.2 mol•L-1•min-1 | D. | v (N2)=0.05mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲烷都能发生加成反应 | |
| B. | 煤焦油、石油、花生油都属于烃 | |
| C. | 甲烷、乙烯、苯都可通过石油分馏得到 | |
| D. |  + +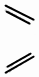 $\stackrel{△}{→}$ $\stackrel{△}{→}$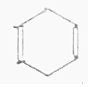 反应属于加成反应 反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
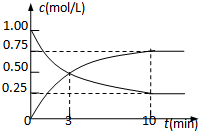 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com