
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
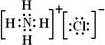 .
. 分析 由元素在周期表中位置,可知①为C、②为N、③为F、④为Na、⑤为Al、⑥为Cl、⑦为Ar、⑧为K、⑨为Br.
(1)最高价氧化物对应的水化物中酸性最强的是高氯酸;
(2)实验室用氯化铵与氢氧化钙在加热条件下制备氨气,反应生成氯化钙、氨气与水;
(3)④和⑤元素最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(4)元素②、⑥与氢元素形成的一种化合物为NH4Cl,由铵根离子与氯离子构成.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为F、④为Na、⑤为Al、⑥为Cl、⑦为Ar、⑧为K、⑨为Br.
(1)最高价氧化物对应的水化物中酸性最强的是HClO4,故答案为:HClO4;
(2)实验室用氯化铵与氢氧化钙在加热条件下制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)④和⑤元素最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,
故答案为:NaOH+Al(OH)3=NaAlO2+2H2O;
(4)元素②、⑥与氢元素形成的一种化合物为NH4Cl,含有离子键、共价键,电子式为: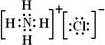 ,
,
故答案为:离子键、共价键;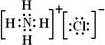 .
.
点评 本题考查元素周期表与元素周期律,侧重对化学用语的考查,注意对基础知识的理解掌握.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在氯气中燃烧产生苍白色火焰 | |
| B. | 铁丝在氯气中燃烧生成FeCl2 | |
| C. | 氯气的水溶液用于漂白,是利用氯气的强氧化性 | |
| D. | 当有大量氯气逸到空气中时,可用浸有NaOH溶液的毛巾捂住鼻子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 若有1 mol NO3-发生氧化反应,则转移8 mol e- | |
| D. | Fe3+的氧化性比HNO3弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
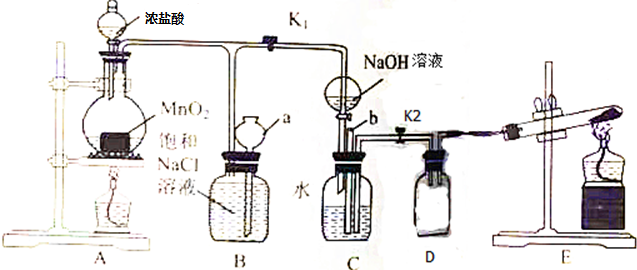
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com