
| A. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 随核电荷数递增,同主族元素的简单阴离子还原性递增减 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
分析 A.IA族含H及碱金属元素,ⅦA族均为非金属元素;
B.第二周期元素中,O、F没有正价;
C.同主族元素,从上到下非金属性减弱;
D.同周期金属元素的化合价越高,失去电子的能力越弱.
解答 解:A.IA族含H及碱金属元素,ⅦA族均为非金属元素,则H与ⅦA族元素间可形成共价化合物,碱金属元素与ⅦA族元素间可形成离子化合物,故A正确;
B.第二周期元素中,O、F没有正价,则第二周期元素从左到右,最高正价从+1递增到+5,故B错误;
C.同主族元素,从上到下非金属性减弱,则简单阴离子从上到下还原性增强,故C错误;
D.同周期金属元素的化合价越高,金属性越弱,失去电子的能力越弱,如Na、Mg、Al的失去电子能力减弱,故D错误;
故选A.
点评 本题考查元素周期表和元素周期律的综合应用,把握同周期、同主族元素性质的变化规律为解答的关键,注意元素性质的特例,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2, 无明显变化.再加入H2O2溶液,红色很快褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①和② | B. | 只有②③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
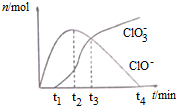
| A. | t1时,溶液中Na+、NH4+、CO32-、S2-可以大量共存 | |
| B. | t2时,溶液中含氯微粒浓度大小:c(ClO-)>c(Cl-)>c(ClO3-) | |
| C. | t3时,离子方程式为:4Cl2+8OH-=ClO3-+ClO-+6Cl-+4H2O | |
| D. | t4时,因c(ClO-)接近于0,所以c(ClO3-)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
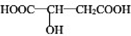 )常用于汽水、糖果的添加剂,
)常用于汽水、糖果的添加剂,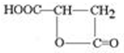 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
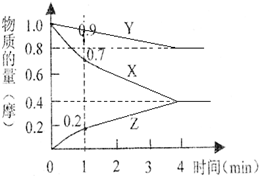 某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.
某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | C3H8的二氯代物共有3种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com