
右图为元素周期表短周期的一部分。E原子的电子层数为n,最外层电子数为2n+l。下列叙述不正确的是( )
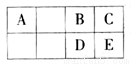
A.C和E氢化物的热稳定性和还原性均依次减弱
B.A与B形成的阴离子可能有AB32-、A2B42-
C.AD2分子中每个原子的最外层均为8电子结构
D.A、D、E的最高价氧化物对应的水化物的酸性依次增强
 习题精选系列答案
习题精选系列答案科目:高中化学 来源:2015-2016学年辽宁省高二下期中化学试卷(解析版) 题型:选择题
下列实验中,为实现实验目的而必须除杂的是:
实验 | 除杂试剂 | 实验目的 | |
① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用银氨溶液检验水解产物的还原性 |
④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
A.只有①②③ B.只有①②④ C.只有②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:推断题
(1)在NaCl溶液中滴加AgNO3溶液, 反应的离子方程式为:__________________
(2)在CH3CH2CH2Cl中滴加AgNO3溶液,现象为_______________________________
(3)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
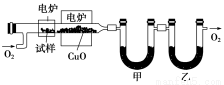
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12 g有机物X的蒸气氧化产生7.04 g二氧化碳和1.80 g水。
步骤二:通过仪器分析得知X的相对分子质量为106。
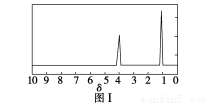
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3。如图Ⅰ。
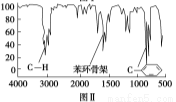
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ。
试填空:
(1)X的分子式为________;X的习惯命名为 。
(2)步骤二中的仪器分析方法称为________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
下列物质的类别与所含官能团都正确的是
A.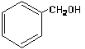 酚类–OH
酚类–OH
B.CH3-O-CH3醚类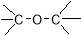
C.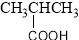 羧酸 –CHO
羧酸 –CHO
D.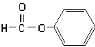 醛类–CHO
醛类–CHO
查看答案和解析>>
科目:高中化学 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:选择题
0.1 mol·L-1HIO3溶液加水稀释的图像如下,下列对该溶液叙述正确的是( )
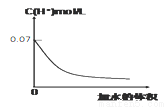
A.若使溶液的pH升高1,可提高溶液的温度
B.若使溶液的pH升高1,将溶液稀释到原体积的10倍
C.0.1 mol·L-1HIO3溶液稀释10倍后,溶液中c(H+)> c(IO3—)> c(HIO3)
D.加水稀释过程中n(HIO3)+n((IO3-)减小
查看答案和解析>>
科目:高中化学 来源:2016届吉林省吉林市高三第三次调研理综化学试卷(解析版) 题型:填空题
由于金属锌本身的价值不高,在我国工业锌废料的回收利用率比较低。某课题组研究利用含少量铜、铁的粗锌制备硫酸锌及相关物质的资源综合利用,其工艺流程图(图中加入的物质均为足量)及有关数据如下:
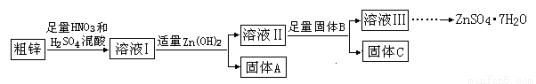
物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
Ksp | 4.0×10—38 | 5.0×10—20 | 2.0×10—16 | 8.5×10—45 | 1.2×10—23 |
请回答下列问题:
(1)固体A的主要成分是 ;加入固体B的主要作用是 。
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为 。
(3)若溶液II中c(Cu2+)为0.05mol·L—1,则溶液II的pH≤ 。
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol·L—1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是 ;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为 。
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的 杂质。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省吉林市高三第三次调研理综化学试卷(解析版) 题型:选择题
将足量的稀盐酸加到由下列物质组成的固体混合物中,只能发生一种类型反应的是
A.Al、Cu、AgNO3 B.Na2O2、Na2SO3、BaCl2
C.CaCO3、Na2SiO3、CH3COONa D.Ba(NO3)2、Fe(OH)2、NaOH
查看答案和解析>>
科目:高中化学 来源:2016届四川省邛崃市高三强化训练一化学试卷(解析版) 题型:填空题
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如右图:
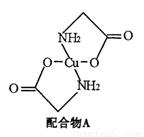
(1)Cu元素基态原子的外围电子排布图为 。
(2)配合物A中碳原子的轨道杂化类型为 。
(3)1mol氨基乙酸钠(H2N-CH2-COONa)含有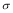 键的数目为 。
键的数目为 。
(4)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体且为负一价阴离子: (写化学式)。
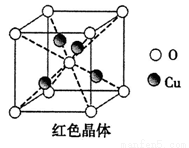
(5)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是 。
(6)配合物A中元素C、H、N、O组成CH4和NO在400~500℃和Pt做催化剂下转化成无毒害物质,利用该反应可以控制机动车尾气排放。该反应方程式为
___________ ________________ 。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三4月质检理综化学试卷(解析版) 题型:实验题
[化学 选修2:化学与技术]
铵盐是重要的化工原料,以N2和H2为原料制取硝酸铵的流程图如下,请回答下列问题:
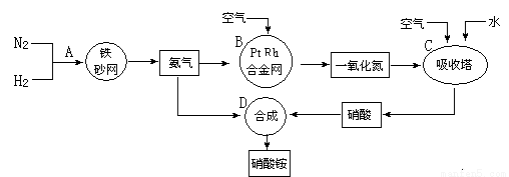
(1)在上述流程图中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)在上述工业生产中,N2与H2合成NH3的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
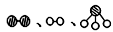 分别表示N2、H2、NH3 。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3 。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
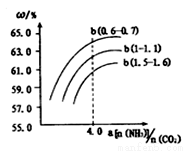
(3)NH3和CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)  CO( NH2)2(s)+H2O(g)
CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:
①b应控制在 ; A.1.5.1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是 。
(4)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(5)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(6)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com