
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
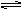 Mg2+(aq)+2OH -(aq)(1分),盐酸中的H+与OH-中和使得OH-浓度减小平衡右移(1分),沉淀溶解
Mg2+(aq)+2OH -(aq)(1分),盐酸中的H+与OH-中和使得OH-浓度减小平衡右移(1分),沉淀溶解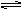 NH3·H2O+H+(2分)
NH3·H2O+H+(2分)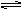 Mg2+(aq)+2OH -(aq),加入HCl后,H+与OH?反应,使OH?浓度减小,沉淀溶解平衡向右移动,Mg(OH)2沉淀溶解。
Mg2+(aq)+2OH -(aq),加入HCl后,H+与OH?反应,使OH?浓度减小,沉淀溶解平衡向右移动,Mg(OH)2沉淀溶解。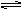 NH3·H2O+H+
NH3·H2O+H+

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:不详 题型:单选题
| A.AlCl3溶液和NaAlO2溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 |
| B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 |
| C.用加热的方法可除去KNO3溶液中混有的Fe3+ |
| D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H++B2-,则下列说法中一定正确的是
H++B2-,则下列说法中一定正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在醋酸钠溶液中:c(CH3COOH) = c(OH-) - c(H+) |
| B.等体积等物质的量浓度的NaCl和NaClO溶液中离子总数:N前<N后 |
| C.1mol?L-1的(NH4)2Fe(SO4)2?6H2O溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) |
| D.0.1 mol?L-1NaHX溶液pH=3,则此溶液中:c(HX-)>c(H2X)>c(X2-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 随pH变化的关系:
随pH变化的关系: | 91:9 | 1:1 | 9:91 |
| 室温下pH | 8.2 | 7.2 | 6.2 |
 = 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
= 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
C.25℃时,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液pH=4.75,c( )+c( )+c( )=c(CH3COOH)+c(H+) )=c(CH3COOH)+c(H+) |
| D.一定物质的量浓度的Na2S溶液中:c(OH-) =c(H+)+2c(H2S) + c(HS-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.②④ | C.①③ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH4+)>c(SO42-)>c(Fe2+)>c(H+) |
| B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-) |
| D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com