

分析 根据实验装置图可知,在A中用高锰酸钾与浓盐酸制得氯气,氯气中有挥发的氯化氢在B装置中用饱和食盐水除去,氯得的氯气通入氢氧化钾溶液中搅拌,生成次氯酸钾,实验中氯气尾气在D装置中用氢氧化钾溶液吸收.
(1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,配平书写离子方程式;
由于盐酸易挥发,制备的氯气中含有HCl,应饱和食盐水吸收HCl除去;
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,充分利用原料,应降低通入氯气的速率;
(3)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中;
(4)用砂芯漏斗过滤,除去氢氧化铁,由于K2FeO4可溶于水、微溶于浓KOH溶液,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,析出K2FeO4晶体,再进行过滤,用乙醇洗涤,减少因溶解导致晶体损失,最后在真空干燥箱中干燥.
解答 解:(1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,由于盐酸易挥发,制备的氯气中含有HCl,应饱和食盐水吸收HCl除去,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;HCl;
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,充分利用原料,缓慢滴加盐酸,减慢生成氯气的速率,
故答案为:缓慢滴加盐酸、装置C用冰水浴中;
(3)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中,具体操作为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中,
故答案为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中;
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3mol•L-1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2-3次后,在真空干燥箱中干燥,
故答案为:用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2-3次后,在真空干燥箱中干燥.
点评 本题考查实验制备方案、氧化还原反应、物质的分离提纯、对条件与操作的分析评价、阅读获取信息能力,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
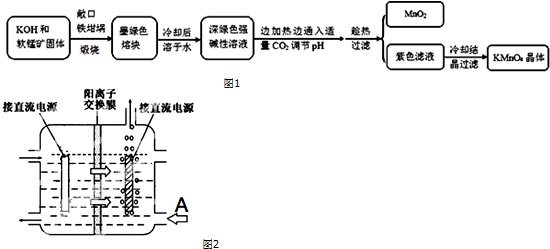
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
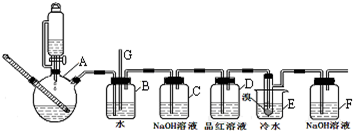
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
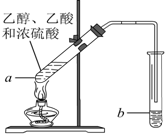 在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:
在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关 | |
| C. | SO2的水溶液能够导电,所以SO2是电解质 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com