
| A. | 2﹕1 | B. | 1﹕2 | C. | 1﹕1 | D. | 1﹕4 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:实验题
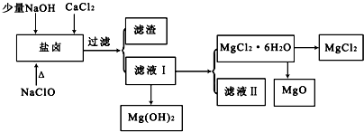
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
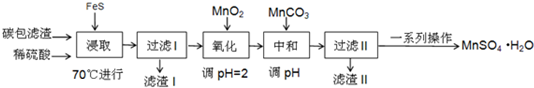
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5×10-18 | 4.6×10-14 | 2×10-54 |
| Fe(OH)2 | Fe(OH)3 | Mn (OH)2 | |
| 开始沉淀时的PH | 6.3 | 2.7 | 8.3 |
| 沉淀完全时的PH | 8.4 | 3.7 | 9.8 |
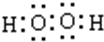 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂属于酯类,在酸性或碱性条件下与水发生水解反应,称为皂化反应 | |
| B. | 淀粉、纤维素没有甜味,它们都是天然高分子化合物,在一定条件下水解都能生成葡萄糖 | |
| C. | 鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 氨基酸分子中都含有-COOH和-NH2二种原子团,能相互反应形成更复杂的多肽化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
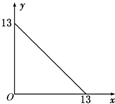 某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
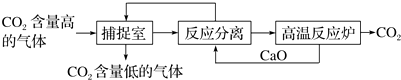
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡ | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
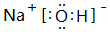 ,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com