
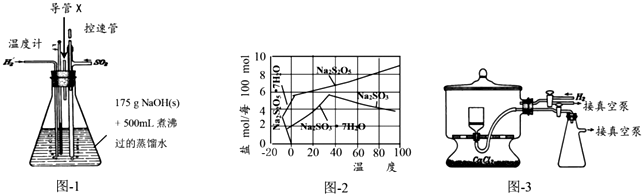
分析 (1)铝和NaOH溶液反应生成偏铝酸钠和氢气;
(2)SO2与NaOH溶液的反应是放热反应导致溶液温度升高;
(3)根据图知,温度越高Na2S2O5溶解度增大,当接近40℃时亚硫酸钠溶解度减小;控制“30℃左右”时,此时溶液中Na2SO3不饱和;
(4)焦亚硫酸钠能被压强氧化;真空干燥时,干燥室内部的压力低,水分在低温下就能气化;
(5)④碘能使淀粉变蓝色,所以可以用淀粉试液检验滴定终点,继续做实验为:加入少量淀粉溶液,继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积.
解答 解:(1)铝和NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)SO2与NaOH溶液的反应是放热反应导致溶液温度升高,所以溶液“温度迅速升高”,故答案为:SO2与NaOH溶液的反应是放热反应;
(3)根据图知,温度越高Na2S2O5溶解度增大,当接近40℃时亚硫酸钠溶解度减小,所以要趁热过滤;控制“30℃左右”时,此时溶液中Na2SO3不饱和,不析出,
故答案为:趁热过滤;此时溶液中Na2SO3不饱和,不析出;
(4)焦亚硫酸钠能被压强氧化,则通入氢气的目的是排出空气,防止焦亚硫酸钠被氧化,
故答案为:排出空气,防止焦亚硫酸钠被氧化;
(5)④继续做实验为:加入少量淀粉溶液,继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积,然后再重复实验,减少实验误差,
故答案为:加入少量淀粉溶液,继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积;
点评 本题考查制备实验方案设计,为高频考点,明确实验原理及物质性质是解本题关键,侧重考查学生实验操作、实验评价、物质制备能力,知道各个仪器的作用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | 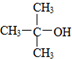 的命名:2,2-二甲基-2-乙醇 的命名:2,2-二甲基-2-乙醇 | |
| C. | 常温下,浓度都为0.1mol•Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者 | |
| D. | 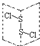 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是复分解反应 | |
| B. | 该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl | |
| C. | 反应中Cl2既是氧化剂,又是还原剂 | |
| D. | 生成2 mol ClO2时转移的电子数为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25.4ρ | B. | 12.7ρ | C. | 6.97ρ | D. | 6.35ρ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 篮烷的分子式为C12H20 | |
| B. | 篮烷分子中存在2个六元环 | |
| C. | 篮烷分子中存在3个五元环 | |
| D. | 篮烷的一氯代物共有4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com