
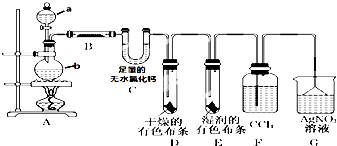
(11分)某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
(1)A是浓盐酸,B为二氧化锰,将A滴入B中时发生反应的离子方程式为______________________________________________;
(2)甲同学用含有0.2molHCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:___________________________________________________。
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是①_________________________,②_________________________(填试剂名称)。
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224mL(标准状况下)Cl2完全反应,则反应过程中转移电子的物质的量为____________________。
科目:高中化学 来源: 题型:
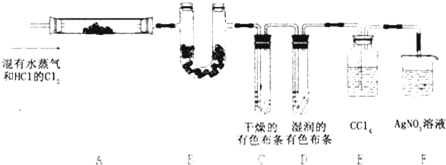
 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 选用试剂 | 实验现象 | |
| 方案1 | d d |
溶液变成(血)红色 溶液变成(血)红色 |
| 方案2 | b b |
下层的四氯化碳溶液依然无色 下层的四氯化碳溶液依然无色 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | b b |
下层(CCl4层)无色 下层(CCl4层)无色 |
| 方案2 | d d |
溶液变为血红色 溶液变为血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com