




 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:

| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:
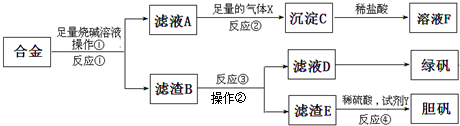
查看答案和解析>>
科目:高中化学 来源: 题型:
为探索工业含铝、铁、铜合金废料的再利用,某同学设计的实验方案如下:
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式 ,
反应②的离子反应方程式 。
(3)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:实验题
为探索工业含铝、铁、铜合金废料的再利用,某同学设计的实验方案如下:

请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式 ,
反应②的离子反应方程式 。
(3)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市高三10月月考化学试卷 题型:填空题
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

请回答:
(1)操作①的名称是 。
(2)写出反应①的化学方程式 ,
反应②的离子反应方程式 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3•6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 ,将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3•6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com