
| A. | 常温常压下,16g 14CH4所含中子数目为8NA | |
| B. | 标准状况下,22.4 L CCl4所含分子数目为NA | |
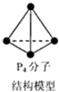
| C. | 6.2g白磷(分子式为P4,分子结构如图所示)所含P-P键数目为0.3NA | |
| D. | 1mol含8个碳原子的某烃分子,最多形成8NA个碳碳单键 |
分析 A、14CH4的摩尔质量为18g/mol,根据质量计算出甲烷的物质的量和含有的中子数;
B.标准状况下四氯化碳为液体,无法计算四氯化碳的物质的量;
C.根据1molP4分子含有6molP-P键计算出6.2g白磷中含有的P-P键数目;
D.依据碳原子的最外层电子数是4,可以形成四个单键分析;
解答 解:A、16g14CH4的物质的量为$\frac{16}{18}$mol=$\frac{8}{9}$mol,含有中子的物质的量为:$\frac{8}{9}$mol,含有质子数为:$\frac{64}{9}$NA,故A错误;
B.在标况下,四氯化碳不是气体,无法计算22.4L四氯化碳的物质的量及分子数,故B错误;
C.6.2g白磷含有P4的物质的量为:$\frac{6.2g}{124g/mol}$=0.05mol,0.05molP4分子中含有P-P键的物质的量为:0.05mol×6=0.3mol,所含P-键数目为0.3NA,故C正确;
D.1mol含8个碳原子的某烃分子,碳原子形成最多化学键时,都以单键和原子形成,所以8个碳原子最多形成7个碳碳键,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | W单质的化学性质很活泼 | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z气态氢化物稳定性最弱的是Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
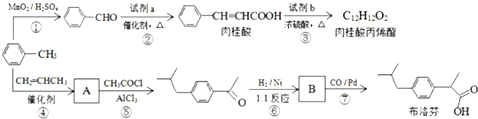
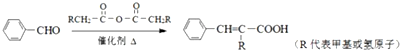
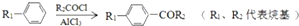
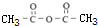 ;
;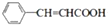 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$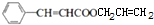 +H2O;
+H2O; ;
;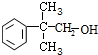 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
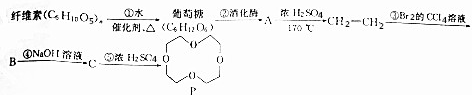
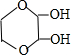 、
、 (任写一种)(不考虑立体异构)
(任写一种)(不考虑立体异构)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2≈1.6×10-3 | B. | 2c(Na+)=c(HCN)+c(CN-) | ||
| C. | 混合溶液的pH<7 | D. | 对混合溶液升温,K1增大、K2减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
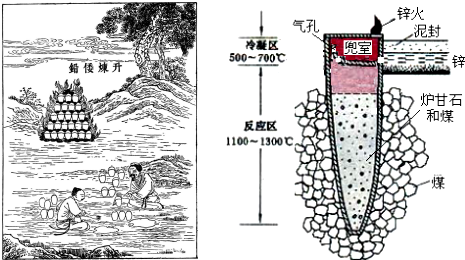
| A. | 升炼倭铅过程包含分解反应和氧化还原反应 | |
| B. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| C. | “泥封”的目的是为了防止得到的锌被氧化 | |
| D. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com