
| A. | 在任何条件下,纯水都呈中性 | |
| B. | 电离平衡常数Ka越小,表示弱电解质电离能力越强 | |
| C. | 为保存FeCl3溶液,要在溶液中加少量硫酸 | |
| D. | 明矾溶液蒸干得到的固体为Al(OH)3 |
分析 A.纯水电离出的氢离子浓度和氢氧根离子浓度相同;
B.相同条件下K越大,酸的电离程度越大,多元弱酸各步电离平衡常数依次减小;
C.保存氯化铁溶液,加入酸抑制水解发生变质,加入硫酸会引入杂质离子硫酸根;
D.硫酸铝钾溶液中铝离子水解,反应生成硫酸钾、硫酸和氢氧化铝,水解过程为吸热反应,加热促进水解,蒸干是蒸发的水,最后得到硫酸铝钾固体.
解答 解:A.纯水电离出的氢离子浓度和氢氧根离子浓度相同,在任何条件下,纯水都呈中性,故A正确;
B.电离平衡常数Ka越小,电离出的离子少,表示弱电解质电离能力越弱,故B错误;
C.氯化铁溶液中水解生成氢氧化铁和盐酸,保存氯化铁溶液,加入盐酸抑制水解,加入硫酸能抑制水解,但会引入杂质离子硫酸根,故C错误;
D.KAl(SO4)2是强酸弱碱复盐,水解生成K2SO4、H2SO4和Al(OH)3,而K2SO4、H2SO4是不挥发性物质,受热不能挥发,即Al2(SO4)3的水解不能彻底,蒸发的是水,最终得到固体的即为KAl(SO4)2,故D错误;
故选A.
点评 本题考查了弱电解质电离平衡影响因素、水的电离特征、盐类水解原理,掌握电离平衡常数概念的表达意义和盐类水解产物的判断是解题关键,题目难度中等.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | △H1+△H2-△H3 | B. | 2△H1+△H2+△H3 | ||
| C. | △H1+0.5△H2+△H3 | D. | △H1+0.5△H2+0.5△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | [A-]=[K+] | B. | [H+]=[OH-]<[K+]<[A-] | C. | V总≥30mL | D. | V总≤30mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的电子式: | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | Mg原子结构示意图: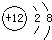 | |
| D. | 硫酸铁的电离方程式 Fe2(SO4)3=2Fe3++3SO42ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
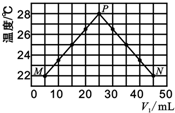 现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述正确的是( )
现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述正确的是( )| A. | 若将CH3COOH改为HCl,P点温度高于28℃ | |
| B. | 从M到N过程中c(H+)逐渐减小 | |
| C. | 混合溶液的导电能力:N>M | |
| D. | 实验的环境温度等于22℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3>I->Fe2+>NO | B. | I->Fe2+>H2SO3>NO | ||
| C. | Fe2+>I->H2SO3>NO | D. | NO>Fe2+>H2SO3>I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、AlO2-、CO32- | |
| B. | 能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3- | |
| C. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| D. | 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①或② | B. | ②或④ | C. | ②或③ | D. | ②或⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com