
锌锰电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
|
| A. | 电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
|
| B. | 电池负极的电极反应式为Zn﹣2e﹣+2 OH﹣=Zn(OH)2 |
|
| C. | 电池工作时,电流由正极通过外电路流向负极 |
|
| D. | 碱性锌锰电池是二次电池 |
| 常见化学电源的种类及其工作原理. | |
| 专题: | 电化学专题. |
| 分析: | A、根据锌与转移电子的关系计算; B、根据负极上的反应类型书写电极反应式; C、根据原电池工作原理中电子的流向来回答; D、可以连续充电放电的电池属于二次电池. |
| 解答: | 解:A、由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则6.5gZn反应转移0.2mol电子,故A正确; B、负极失电子,发生氧化反应,所以负极的电极反应式为:Zn﹣2e﹣+2OH﹣=Zn(OH)2,故B正确; C、电池工作时,电子由负极流向正极,电流由正极通过外电路流向负极,故C正确; D、碱性锌锰电池是一次电池,不可以连续充放电,故D错误. 故选D. |
| 点评: | 本题考查原电池,理解这类题的关键是理解原电池原理,在反应中,电子从负极经外电路流向正极,同时溶液中的阴、阳离子分别不断移向负极、正极,构成闭合回路. |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
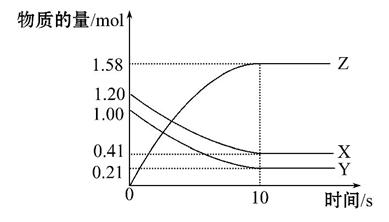
A.从反应开始到10 s时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.10 s后,该反应停止进行
C.反应的化学方程式为2X(g)+Y(g)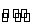 2Z(g)
2Z(g)
D.从反应开始到10 s时,平均反应速率v(X)=v(Y)=0.039 5 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组有机物中,只需加入溴水就能一一鉴别的是( )
|
| A. | 己烯、苯、四氯化碳 | B. | 苯、己炔、己烯 |
|
| C. | 己烷、苯、环己烷 | D. | 甲苯、己烷、己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知胆矾失水的化学反应方程式为:CuSO4•5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:
CuSO4(s)=Cu2+(aq)+SO42﹣(aq);△H=﹣Q2kJ/mol
(3)胆矾溶于水时,溶液温度降低.Q1与Q2的关系是(Q1、Q2为正数)( )
|
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
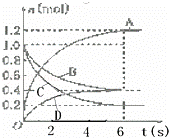
|
| A. | 该反应的化学方程式为3B+4D⇌6A+2C |
|
| B. | 反应进行到1 s时,v(A)=v(D) |
|
| C. | 反应进行到6 s时,B的平均反应速率为0.05 mol/(L•s) |
|
| D. | 反应进行到6 s时,各物质的反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是( )
|
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多 |
|
| B. | 由C(石墨)→C(金刚石)△H=+119kJ•mol﹣1可知,金刚石比石墨稳定 |
|
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧热的化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1 |
|
| D. | 在稀溶液中,H+(aq)+OH﹣(aq)═(H2O)(l)△H=﹣57.3kJ•mol﹣1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于“人工固氮”的新方法研究.
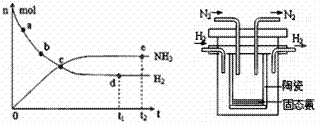
(1)目前合成氨技术原理为:N2(g)+3H2(g)⇌2NH3(g);△H=﹣92.4kJ•mol﹣1.
①673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示.下列叙述正确的是 .
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点 e处的n(N2)相同
D.773K,30MPa下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨.其实验装置如图,阴极的电极反应式 .
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)⇌2NH3(g)+ O2(g)△H=a kJ•mol﹣1
O2(g)△H=a kJ•mol﹣1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323:] |
| NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a 0;△S 0(填“>”、“<”或“=”);该反应属于
A.一定自发 B.一定不自发 C.高温自发 D.低温自发
②已知:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1
2H2(g)+O2(g)=2H2O(l)=﹣571.6kJ•mol﹣1则N2(g)+3H2O(1)=2NH3(g)+ O2(g)△H= kJ•mol﹣1.
O2(g)△H= kJ•mol﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中反应速率一定相同的是( )
A.表面积完全相同的锌片分别与同浓度、同体积的盐酸、硫酸在相同温度下反应
B.100 ℃时,向A、B两个容器中分别各加入0.2 mol HI发生分解反应
C.向分别盛有100 mL、200 mL水的两个烧杯中各加入少量表面积相同的钠
D.0.5 mol·L-1的NaHCO3(aq)分别与1 mol·L-1盐酸和1 mol·L-1的醋酸溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com