

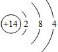 .D燃烧放出大量热量,有望成为二十一世纪的新能源,与“传统能源”相比,它具有便于储运,比较安全(写出两点)等更加优越的特点.
.D燃烧放出大量热量,有望成为二十一世纪的新能源,与“传统能源”相比,它具有便于储运,比较安全(写出两点)等更加优越的特点.分析 A的焰色反应呈黄色,应含有Na元素,C是目前制作光导纤维的主要原料,为SiO2,由转化关系可知D为Si,则可知a为NaOH,A为Na2SiO3,B为H2SiO3,b为盐酸或硫酸,以此解答该题.
解答 解:A的焰色反应呈黄色,应含有Na元素,C是目前制作光导纤维的主要原料,为SiO2,由转化关系可知D为Si,则可知a为NaOH,A为Na2SiO3,B为H2SiO3,b为盐酸或硫酸,
(1)由以上分析可知B为H2SiO3,故答案为:H2SiO3;
(2)D为Si,原子核外有3个电子层,最外层电子数为4,原子结构示意图为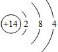 ,硅在常温下为固态,便于储运,且性质较不活泼,比较安全,而氢气难以液化,不便于储运,且易爆炸,故答案为:
,硅在常温下为固态,便于储运,且性质较不活泼,比较安全,而氢气难以液化,不便于储运,且易爆炸,故答案为: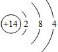 ;便于储运,比较安全;
;便于储运,比较安全;
(3)由以上分析可知a为氢氧化钠溶液,b为盐酸或硫酸,故答案为:氢氧化钠溶液;盐酸或硫酸.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,本题应抓住框图中的转化关系,以题设条件C是目前制作光导纤维的主要原料为突破口进行推断,并结合已有知识进行设定与推测,题目难度中等


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | N2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | 向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解 | |
| C. | 可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层 | |
| D. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1 mol/L的NaCl溶液 | B. | 75mL 2 mol/L的NH4Cl溶液 | ||
| C. | 150mL 3 mol/L的KCl溶液 | D. | 75mL 1 mol/L的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ||||||||
| 二 | A | B | C | |||||
| 三 | D | E | F | G |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
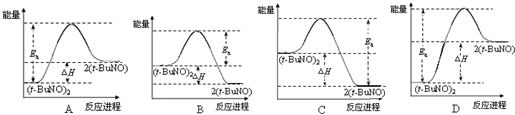
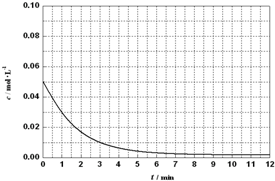
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
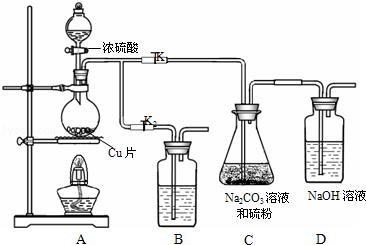
| 编 号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com