分析:依据化学平衡三段式列式计算,5s内C的平均反应速率为0.2mol?L
-1?s
-1,生成C物质的量=0.2mol?L
-1?s
-1×2L×5s=2mol,生成D为1mol,
3A(g)+B(g)?x C(g)+2D(g)
起始量(mol) 2.5 2.5 0 0
变化量(mol) 1.5 0.5 0.5x 1
平衡量(mol) 1 2 0.5x 1
0.5x=2mol,x=4
(1)依据计算得到x值;
(2)转化率=
×100%;
(3)依据平衡时消耗B物质的量0.5mol,反应放热Q kJ的热量,消耗1mol放热2QKJ,结合热化学方程式书写,标注物质聚集状态和对应焓变;
(4)计算反应后混合气体的物质的量之和,恒温恒压下,体积之比之比等于物质的量之比,据此计算;
(5)CO(g)+NO
2(g)?CO
2(g)+NO(g)在一定条件下达到化学平衡后,降低温度,混合物的颜色变浅说明平衡正向进行,正反应为放热反应;结合化学平衡移动原理分析选项判断;
解答:
解:(1)5s内C的平均反应速率为0.2mol?L
-1?s
-1,同时生成1molD,故生成的C的物质的量为5s×0.2mol?L
-1?s
-1×2L=2mol,化学计量数之比等于物质的量之比,故x:2=2mol:1mol,解得x=4,
故答案为:4;
(2)由方程式3A(g)+B(g)?4C(g)+2D(g)可知,参加反应的B的物质的量为1mol×
=0.5mol,故B的转化率为
×100%=20%,
故答案为:20%;
(3)0.5molB反应放出的热量为QkJ,故1molB反应放出的热量为QkJ×
=2QkJ,故该反应的热化学方程式为3A(g)+B(g)?4 C(g)+2D(g)△H=-2Q kJ?mol
-1,
故答案为:3A(g)+B(g)?4 C(g)+2D(g)△H=-2Q kJ?mol
-1;
(4)反应生成1molD,则:
3A(g)+B(g)?4 C(g)+2D(g) 气体物质的量增大△n
2 2
1mol 1mol
故平衡时混合气体的物质的量为2.5mol+2.5mol+1mol=6mol,恒温恒压下,体积之比之比等于物质的量之比,令平衡时的体积为V,则5mol:6mol=2L:V,解得V=2.4L;
故答案为:2.4L;
(5)已知:CO(g)+NO
2(g)?CO
2(g)+NO(g)在一定条件下达到化学平衡后,降低温度,混合物的颜色变浅下列关于该反应的说法正确的是
A.降低温度,混合物的颜色变浅,说明平衡正向进行,该反应为放热反应,故A正确;
B.降温后平衡正向进行,CO的浓度减小,故B错误;
C.降温后平衡正向进行,NO
2的转化率增加,故C正确;
D.降温后平衡正向进行,NO的体积分数增大,故D正确;
E.反应是气体体积不变的反应,增大压强平衡不动,但物质浓度增大混合气体的颜色变深,故E错误;
F.恒容时,通入He气体,总压增大,分压不变,平衡不动,混合气体颜色不变,故F正确;
G.恒压时,通入He气体,为保持恒压,体积增大,混合气体颜色变浅,故G错误;
故答案为:ACDF.



 阅读快车系列答案
阅读快车系列答案
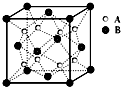 有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅类似,高熔点、高硬度的二氧化碳晶体,下列关于该晶体的说法不正确的是( )
有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅类似,高熔点、高硬度的二氧化碳晶体,下列关于该晶体的说法不正确的是( )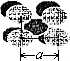 如图,金属钨晶体的密堆结构模型图.从金属钨晶体中划分出的一个晶胞(在晶体中,仍保持一定几何形状的最小单位,又称为单元晶胞),它是一个立方体,立方体中每个角各有一个钨原子,中心有一个钨原子.假定金属钨为等径的钨原子钢性球,采取上述方法密堆积.试回答下列问题:
如图,金属钨晶体的密堆结构模型图.从金属钨晶体中划分出的一个晶胞(在晶体中,仍保持一定几何形状的最小单位,又称为单元晶胞),它是一个立方体,立方体中每个角各有一个钨原子,中心有一个钨原子.假定金属钨为等径的钨原子钢性球,采取上述方法密堆积.试回答下列问题: