
| A. | 1-溴丙烷与氢氧化钾的乙醇溶液共热:CH3CH2CH2Br+KOH$→_{△}^{乙醇}$CH3CH2CH2OH+KBr | |
| B. | 将乙酸乙酯、H218O和稀硫酸充分混合并加热:CH3COOCH2CH3+H218O$→_{△}^{稀硫酸}$CH3COOH+CH3CH218OH | |
| C. | 用食醋除去水瓶里的水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH$→_{△}^{水浴}$CH3COO-+NH4++3NH3+2Ag↓+H2O |
分析 A.1-溴丙烷与氢氧化钾的乙醇溶液共热发生消去反应;
B.依据酯水解反应的原理解答;
C.醋酸为弱酸应保留化学式;
D.乙醛与银氨溶液发生氧化还原反应生成乙酸铵、氨气和水、银.
解答 解:A.1-溴丙烷与氢氧化钾的乙醇溶液共热发生消去反应,化学方程式:CH3CH2CH2Br+KOH$→_{△}^{乙醇}$CH3CH=CH2+KBr+H2O,故A错误;
B.将乙酸乙酯、H218O和稀硫酸充分混合并加热,化学方程式:CH3COOCH2CH3+H218O$→_{△}^{稀硫酸}$CH3CO18OH+CH3CH2OH,故B错误;
C.用食醋除去水瓶里的水垢,离子方程式:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.用银氨溶液检验乙醛中的醛基,离子方程式:CH3CHO+2Ag(NH3)2++2OH$→_{△}^{水浴}$CH3COO-+NH4++3NH3+2Ag↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确有机物结构及性质是解题关键,注意酯水解原理,题目难度中等.


科目:高中化学 来源: 题型:解答题
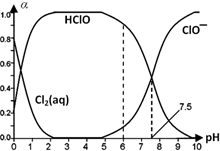 Cl2及其化合物在生产、生活中有广泛用途,回答下列问题.
Cl2及其化合物在生产、生活中有广泛用途,回答下列问题. HClO+H++Cl-或Cl2(aq)+H2O
HClO+H++Cl-或Cl2(aq)+H2O HClO+HCl、HClO
HClO+HCl、HClO H++ClO-.
H++ClO-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g冰中最多含有氢键的数目为4NA | |
| B. | 0.1L3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| C. | 7.8gNa2O2中阴、阳离子总数为0.4NA | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱可用于治疗胃酸过多的药剂 | |
| B. | 铝制容器可用于常温下贮存、运输浓硫酸 | |
| C. | 二氧化硅可用于制造光导纤维和石英坩埚 | |
| D. | 过氧化钠可用作漂白剂和呼吸面具中的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
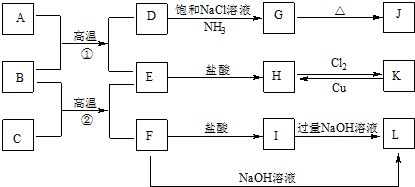
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na3PO4═3Na++P5++4O2- | B. | H2SO4═H++SO42- | ||
| C. | NH3•H2O?NH4++O2-+H+ | D. | NH4NO3═NH4++NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将1molCH3COONa溶于水,向其中加入醋酸至溶液pH=7,此溶液中CH3COO-的数目约为6.02×1023 | |
| B. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-CH3COONa溶液与0.1mol•L-HCl溶液等体积混合:c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| D. | 10mL0.1mol•L-1醋酸溶液与20mL0.1mol•L-NaOH溶液混合:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
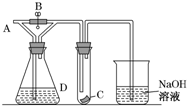 如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )
如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | 浓盐酸 | D. | 饱和NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com