

分析 A、B、C是单质,D、E、F是化合物.A是第三周期原子序数最小的元素,则A为Na,B是除稀有气体外第三周期原子序数最大的元素,则B为Cl2,E是一种淡黄色固体,A点燃生成E,则E为Na2O2,C为O2,A与氧气没有点燃的条件下生成D为Na2O,A与B反应生成F为NaCl,据此答题.
解答 解:A、B、C是单质,D、E、F是化合物.A是第三周期原子序数最小的元素,则A为Na,B是除稀有气体外第三周期原子序数最大的元素,则B为Cl2,E是一种淡黄色固体,A点燃生成E,则E为Na2O2,C为O2,A与氧气没有点燃的条件下生成D为Na2O,A与B反应生成F为NaCl,
(1)A为Na,A在元素周期表中的位置是第三周期第ⅠA族,
故答案为:第三周期第ⅠA族;
(2)根据上面的分析可知,D为Na2O,F为NaCl,
故答案为:Na2O、NaCl;
(3)E为Na2O2,E与水反应的化学方程式为2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑.
点评 本题考查无机物推断,涉及Na元素化合物性质,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
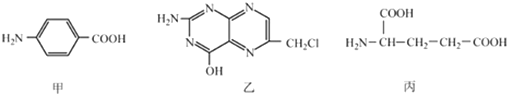
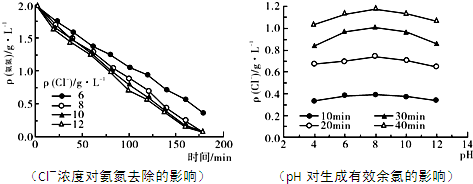
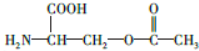 .
.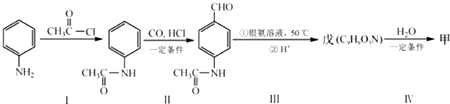
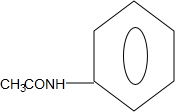 +CO$→_{△}^{HCl}$
+CO$→_{△}^{HCl}$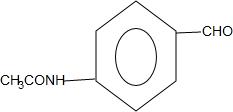 .
.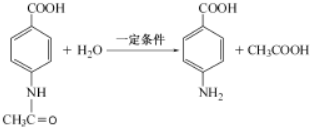 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )| A. | 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | |
| B. | 取10 mL该硫酸于烧杯中,再加18.4 mL的水,可配得49%的硫酸 | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Z)=0.45 mol•L-1 | B. | c(Z)=1.20 mol•L-1 | C. | c(W)=1.00 mol•L-1 | D. | c(W)=0.80 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 将二氧化硫通入到 一定量氯水中 | 将氨水滴入到一定量 氯化铝溶液中 | 将铜粉加入到一定量 浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
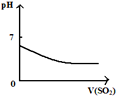 | 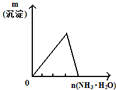 | 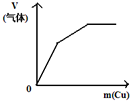 | 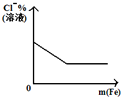 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
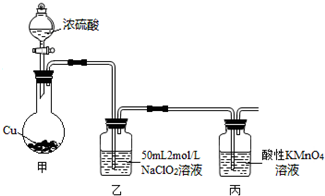
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com