
| A. | 硫酸、纯碱、偏铝酸钠和过氧化钠分别属于酸、碱、盐和氧化物 | |
| B. | 乙醇、次氯酸钠和二氧化硫分别属于非电解质、强电解质和弱电解质 | |
| C. | Na、Al、Cu通常分别用电解法、热分解法和置换法冶炼得到 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
分析 A.纯碱是碳酸钠,属于盐;
B.电解质是指:在水溶液中或熔融状态下能够导电的化合物,常见的电解质包括:酸、碱、盐、金属氧化物和水;
C.Na、Mg、Al等活泼或较活泼金属:电解法;Fe、Zn、Cu等中等活泼金属:以C、CO或H2做还原剂;Hg、Ag等不活泼金属:热分解法;
D.化石能源:指煤、石油、天燃气等;二次能源:由一次性能源直接或间接转换而来的能源:煤气、氢能、电能、汽油、沼气;可再生能源:不随其本身的转化或被人类利用而减少的能源:太阳能、生物能、水能.
解答 解:A.纯碱是碳酸钠,属于盐,不是碱,故A错误;
B.乙醇、次氯酸钠和二氧化硫分别属于非电解质、强电解质和非电解质,故B错误;
C.Na、Al、Cu可以分别用电解法、电解法和置换法冶炼得到,故C错误;
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源,故D正确;
故选:D.
点评 本题为综合题,考查了物质的分类、电解质判断、金属的冶炼,题目难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:填空题
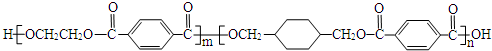
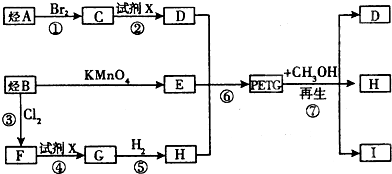
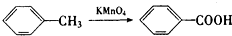

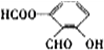 、
、 、
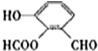
、
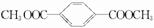 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-n-2}{w•m}$ mol | B. | $\frac{w?m-n?}{n}$mol | C. | $\frac{w}{m}$(m-n-2)mol | D. | $\frac{w}{m}$(m-n+2)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
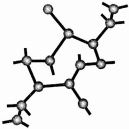 氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示:
氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示: ,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.
,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NaAlO2 溶液:H+、Na+、Cl-、SO42- | |
| D. | 由水电离出的c(OH-)=1×10-12mol•L-1的溶液中:NH4+、HCO3-、Na+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com