
【题目】为检验一批因露置而部分变质的Ba(OH)2药品的成分,某化学探究性学习小组设计了方案对其进行将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。

(1) 写出硫酸工业尾气与过量的Ba(OH)2反应的离子方程式:________________________
(2)提出以下三种合理假设:(已知在空气中Ba(OH)2很难生成酸式盐)
假设一:药品成分为Ba(OH)2和BaSO4、BaSO3;
假设二:药品成分为Ba(OH)2和________________;
假设三:药品成分为Ba(OH)2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
实验操作 | 预期实验现象和结论 |
| 若____________________,假设一成立; |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
【答案】Ba2++2OH-+SO2=BaSO3↓+H2O BaSO4、BaCO3 BaSO4、BaCO3、BaSO3 将气体依次通过①品红溶液、②足量的酸性高锰酸钾溶液、③澄清石灰水 ①褪色,②颜色变浅,③无明显现象 ①和②无明显现象,③变浑浊 ①褪色,②颜色变浅,③变浑浊 否
【解析】
(1) 硫酸工业尾气SO2与过量的Ba(OH)2反应,生成BaSO3;
(2)BaSO3可以被空气中的氧气氧化为BaSO4,空气中的二氧化碳可以和Ba(OH)2反应生成BaCO3,据此可以提出合理假设;
(3)上述实验中生成的气体有CO2和SO2,用石灰水检验CO2,可以证明BaCO3的存在;用品红检验SO2,可以证明BaSO3的存在。当BaCO3和BaSO3都存在时,和盐酸反应生成了CO2和SO2,要先检验SO2,然后用高锰酸钾溶液除去SO2,再检验CO2。
(4)当所加固体质量为12.27 g时,可能是药品成分与盐酸刚好完全反应,也可能在质量小于12.27g时已经反应完全。
(1)硫酸工业尾气主要含有SO2,它与过量的Ba(OH)2反应的离子方程式为Ba2++2OH-+SO2= BaSO3↓+H2O。
(2)BaSO3可以被空气中的氧气氧化为BaSO4,空气中的二氧化碳可以和Ba(OH)2反应生成BaCO3,可以确定假设二Ba(OH)2和BaSO4、BaCO3 ,假设三Ba(OH)2和BaSO4、BaCO3、BaSO3。
(3)把反应产生的气体①分别通入到品红溶液中,②足量的酸性高锰酸钾溶液、③澄清石灰水。若品红溶液褪色,就证明气体中含有含有SO2,原固体中含有BaSO3;足量的酸性高锰酸钾溶液中,溶液颜色变浅,就证明产生了SO2,原固体中含有BaSO3;澄清石灰水无明显现象,就证明无CO2产生,原固体中没有BaCO3.即证明假设一成立。若①和②无明显现象,③澄清石灰水变浑浊,则证明假设二成立;若①品红溶液褪色,②酸性高锰酸钾溶液颜色变浅,③澄清石灰水变浑浊,则证明假设三成立。
(4)由图像可知放出的气体体积最大值是672ml。在加入固体为12.27g时,气体体积为672ml,可能是药品成分与盐酸刚好完全反应,也可能在质量小于12.27g时已经反应完全。放出气体的体积就已经达到最大值。因此该组同学的说法是有偏差的。


科目:高中化学 来源: 题型:
【题目】下列反应中,生成的有机物只有一种的是
A.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
B.新戊烷和氯气发生取代反应生成一氯取代物的反应
C.苯酚与浓溴水发生取代反应生成一溴苯酚的反应
D.异戊烷和氯气发生取代反应生成一氯取代物的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下
![]()
下列说法不正确的是( )。
A.C12H22O11属于二糖B.1mol葡萄糖可分解成3mol乙醇
C.可用碘水检验淀粉是否完全水解D.不能用分液操作分离乙醇和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图),下列对于试管内发生的反应及现象的说法正确的是( )
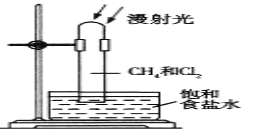
A. 反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生
B. 将该装置放在黑暗处,![]() 与
与![]() 也能反应
也能反应
C. 该反应仅得到一种有机产物
D. ![]() 和
和![]() 完全反应后液面上升,液体充满试管
完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种白色易溶于水的固体,溶液呈碱性,其外观与氯化钠相似,有咸味,俗称工业盐;是一 种重要的化学试剂、漂白剂和食品添加剂。已知亚硝酸盐能被溴水氧化,在酸性条件下能氧化亚铁离子; 亚硝酸银是可溶于稀硝酸的白色沉淀。
请完成以下填空:
(1)N原子最外层电子的轨道排布式为_______;用一个事实说明氮和氧非金属强弱_______。
(2)酸性条件下,NaNO2溶液只能将I-氧化为I2,同时生成NO。写出此反应①的离子方程式并标出电子转移的方向和数目______。
(3)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,工业上氧化卤水中的I-提取单质I2选择了价格并不便宜的亚硝酸钠,可能的原因是_______。
(4)在盐酸溶液中加入亚硝酸钠溶液至中性,则c(Cl-)_____c(HNO2)(填“<”、“>”或“=”)。
(5)设计一种鉴别亚硝酸钠和氯化钠的实验方案。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空。
(1)25℃时,已知 0.1mol·L-1 CH3COOH 溶液的 pH=3,其电离度为__,由水电离的c(H+)=__。
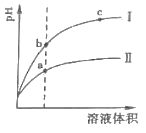
(2)相同 pH的 CH3COOH溶液和 HCl溶液加水稀释,其 pH变化情况如曲线I、II所示,其中表示 HCl溶液的是曲线__,a、b两点中,导电能力更强的是__。
(3)氨水和盐酸等浓度等体积混合后,溶液呈酸性的原因是(用离子方程式表示)__。此时,该混合溶液中离子浓度由大到小的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质Ⅲ(2,3-二氢苯并呋喃)是一种重要的精细化工原料,其合成的部分流程如下:
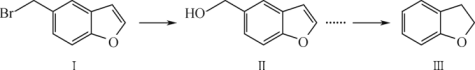
下列叙述正确的是
A. 物质Ⅲ的核磁共振氢谱图显示有四种不同环境的氢
B. 物质Ⅰ在NaOH醇溶液中加热可发生消去反应
C. 物质Ⅱ中所有原子可能位于同一平面内
D. 物质Ⅲ与足量H2加成所得产物分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用反应![]()
![]() TiCl4(g)+CO2 (g),在无水无氧下制取
TiCl4(g)+CO2 (g),在无水无氧下制取![]() ,实验装置如图所示
,实验装置如图所示![]() 、
、![]() 的沸点分别为:
的沸点分别为:![]() 、
、![]() ,
,![]() 与
与![]() 互溶
互溶![]() 。下列说法正确的是
。下列说法正确的是![]()
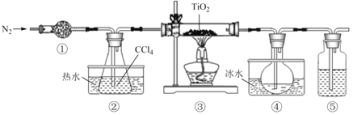
A.![]() 、
、![]() 中分别盛装碱石灰、NaOH溶液
中分别盛装碱石灰、NaOH溶液
B.![]() 热水的作用是使
热水的作用是使![]() 气化,
气化,![]() 冰水的作用是使
冰水的作用是使![]() 冷凝
冷凝
C.![]() 反应结束,先停止通
反应结束,先停止通![]() ,再停止加热
,再停止加热
D.分离![]() 中的液态混合物,采用的操作是分液
中的液态混合物,采用的操作是分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com