
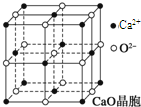
 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C
| ||
| ||
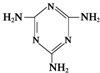 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸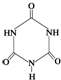 后,三聚氰酸与三聚氰胺分子相互之间通过
后,三聚氰酸与三聚氰胺分子相互之间通过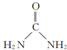 ,
, ;
;

科目:高中化学 来源: 题型:
| A、100mL1mol/L Al2(SO4)3溶液中,Al3+数为0.2×6.02×1023 |
| B、0.1mol锌与100mL1mol/L 的稀盐酸充分反应,产生氢气的分子数为0.1×6.02×1023 |
| C、C60和C70的混合物共12g,其中所含碳原子数为6.02×1023 |
| D、1mol甲基(-CH3)与1mol氢氧根(OH-)所含电子数均为10×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫离子的电子排布式:1s22s22p63s23p4 |
B、H2O的电子式: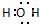 |
C、N原子最外层电子的轨道表示式: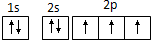 |
D、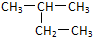 的名称:2-乙基丙烷 的名称:2-乙基丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制溶液时,将量筒中液体倒入烧杯后,应将量筒洗涤,将洗涤液也倒入烧杯 |
| B、用干燥的pH试纸分别测1mol?L-1的NaOH溶液和1mol?L-1的H2SO4的pH |
| C、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并不断搅拌 |
| D、向酒精灯加酒精时,应将试剂瓶中的酒精直接倒入酒精灯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
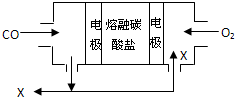 用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )
用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )| A、X物质的化学式为CO2 |
| B、通入O2的电极为正极 |
| C、负极的电极反应式为CO+CO32--2e-=2CO2 |
| D、电池工作时,转移0.5mol电子,理论上消耗O22.8L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com