
 (其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化:
(其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化:
 ,A为
,A为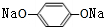 .M(C2H2O4)能与NaHCO3溶液反应,含有羧基,由B连续氧化得到,则B中含有羟基,结构X的部分结构可知,G的结构简式为
.M(C2H2O4)能与NaHCO3溶液反应,含有羧基,由B连续氧化得到,则B中含有羟基,结构X的部分结构可知,G的结构简式为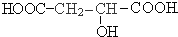 ,N为
,N为 ,结合X的分子式可知,B为HOCH2CH2OH,D为OHC-CHO,M为HOOC-COOH,综上分析可知X为
,结合X的分子式可知,B为HOCH2CH2OH,D为OHC-CHO,M为HOOC-COOH,综上分析可知X为 ,据此解答.
,据此解答. ,A为
,A为 .M(C2H2O4)能与NaHCO3溶液反应,含有羧基,由B连续氧化得到,则B中含有羟基,结构X的部分结构可知,G的结构简式为
.M(C2H2O4)能与NaHCO3溶液反应,含有羧基,由B连续氧化得到,则B中含有羟基,结构X的部分结构可知,G的结构简式为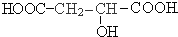 ,N为
,N为 ,结合X的分子式可知,B为HOCH2CH2OH,D为OHC-CHO,M为HOOC-COOH,综上分析可知X为
,结合X的分子式可知,B为HOCH2CH2OH,D为OHC-CHO,M为HOOC-COOH,综上分析可知X为 ,
, ,故答案为:
,故答案为: ;
; ;B为HOCH2CH2OH,名称为乙二醇,故答案为:
;B为HOCH2CH2OH,名称为乙二醇,故答案为: ;乙二醇;
;乙二醇;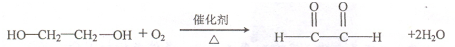 ,
, +2CO2+2H2O→
+2CO2+2H2O→ +2NaHCO3,
+2NaHCO3, ;
; +2CO2+2H2O→
+2CO2+2H2O→ +2NaHCO3;
+2NaHCO3;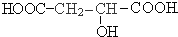 )互为同分异构体,H的分子中只含有醛基、羧基、羟基三种官能团,且同一个碳原子上不能同时连有两个羟基,则H的分子结构有:
)互为同分异构体,H的分子中只含有醛基、羧基、羟基三种官能团,且同一个碳原子上不能同时连有两个羟基,则H的分子结构有: ,故答案为:2.
,故答案为:2.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Na2O2与CO2 |
| B、Na与O2 |
| C、NaOH与CO2 |
| D、Fe与HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同周期金属元素的最外层电子越多,其原子失电子能力越强 |
| B、对于HF、HCl、HBr其熔、沸点随其相对分子质量的增大而升高 |
| C、ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| D、同主族元素的简单阴离子还原性越强,其盐类的水解程度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| CH3OH(g)浓度(mol?L-1) | c1 | c2 |
| 反应能量变化 | 放出29.4kJ | 吸收akJ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质,为了测定该产品中碳酸钠的纯度,某化学研究性学习小组设计有关方案进行如图实验:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质,为了测定该产品中碳酸钠的纯度,某化学研究性学习小组设计有关方案进行如图实验:| 时间/s | 0 | 5 | 10 | 15 |
| 读数/g | 215.20 | 211.40 | 208.60 | 208.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、品红溶液 | B、石蕊溶液 |
| C、氯水 | D、碘化钾-淀粉溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com