
| A. | 24Mg32S 晶体中电子总数与中子总数之比为1:1 | |
| B. | CO2和PCl5分子中各原子最外层都满足8 电子结构 | |
| C. | 若aXm+和bYn-两种离子电子层结构相同,则a-b=n-m | |
| D. | 元素周期表中第4 列元素形成的化合物数目最多 |
分析 A.电子数等于质子数,利用中子数=质量数-质子数计算原子的中子数,进而计算中子总数;
B.PCl5中P元素化合价为+5价,P原子最外层电子数是5;
C.aXm+和bYn-两种离子的电子层结构相同,则两离子核外电子数相等,阳离子核外电子数=质子数-所带电荷数,阴离子核外电子数=质子数+所带电荷数;
D.碳族元素形成化合物的种类最多.
解答 解:A.1mol晶体中电子总的物质的量为(12+16)mol=28mol,中子总的物质的量为[(24-12)+(32-16)]mol=28mol,电子总数与中子总数之比为28mol:28mol=1:1,故A正确;
B.PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构,故B错误;
C.aXm+和bYn-的电子层结构相同知,这两种离子的核外电子数相等,核外电子数=核内质子数-阳离子的电荷数=核内质子数+阴离子的电荷数,所以得:a-m=b+n,即a-b=n+m,故C错误;
D.第14列为碳族元素,C元素可以形成有机物,故该列元素形成化合物的种类最多,故D错误;
故选A.
点评 本题考查了原子构成微粒之间的关系、分子结构以及周期表中各族元素的排列顺序等,难度不大,注意利用离子的电子层结构相同来列等式解答.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
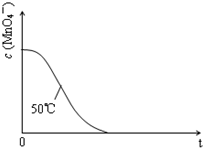 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案. | 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为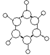 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成 |
| E | ①由C、H、O三种元素组成;②球棍模型为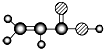 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳和水反应吸收131.3kJ 能量 | |
| B. | 1mol 碳和1mol 水反应生成一氧化碳和氢气并吸收131.3kJ 热量 | |
| C. | 1mol 固态碳和1mol 水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ | |
| D. | 1 个固态碳原子和1 分子水蒸气反应吸热131.1kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
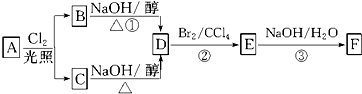
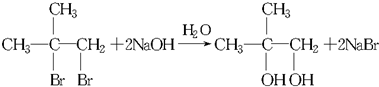 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
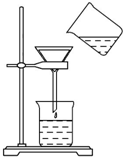 将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:
将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Zn的质量/g | Zn的形状 | 温度/℃ | 溶于酸的时间/s | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 45 | 25 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 薄片 | 15 | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com