
| A. | 向Ge(OH)4中加入盐酸:OH-+H+═H2O | |
| B. | MnO2 与浓盐酸反应制Cl2:MnO2+4HCl═Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O |
分析 A.Ge(OH)4为难溶物,离子方程式中不能拆开;
B.该反应需要加热,浓盐酸中的HCl在离子方程式中需要拆开;
C.醋酸为弱酸,离子方程式中醋酸不能拆开;
D.双氧水将碘离子氧化成碘单质.
解答 解:A.向Ge(OH)4中加入盐酸,Ge(OH)4不能拆开,正确的离子方程式为:Ge(OH)4+4H+═4H2O+Ge4+,故A错误;
B.MnO2与浓盐酸加热反应制Cl2,正确的离子方程式为:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故B错误;
C.醋酸和碳酸钙都需要保留化学式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.双氧水中加入稀硫酸和KI溶液,发生氧化还原反应生成碘单质,反应的离子方程式为:H2O2+2H++2I-═I2+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式等,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、NO3-、Cl- | B. | K+、HCO3-、SO42-、OH- | ||
| C. | ClO-、Cl-、Na+、OH- | D. | Na+、K+、SiO32-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的网状结构中,由共价键形成的硅原子环中,最小的环上有6个硅原子 | |
| B. | 氯化铯晶体中,Cs+的配位数为8 | |
| C. | 氯化钠晶体中,每个Cl-周围距离相等且最近的Cl-有6个 | |
| D. | 干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为同分异构体 | B. | 最简式相同 | ||
| C. | 互为为同系物 | D. | 每个烃分子含相同数目的碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 赏心悦目的雕花玻璃是用氢氟酸对玻璃刻蚀制成的 | |
| B. | 正常雨水的PH为7 | |
| C. | 生物质能的缺点是严重污染环境 | |
| D. | 煤、石油、沼气是当今世界最重要的三种化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的氧化物均能和水反应 | |
| B. | X与Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | X的原子半径一定大于Y的原子半径 | |
| D. | X与Y的简单离子不可能具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| E | A | |||
| B | C | D |
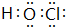 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
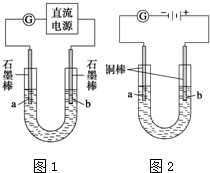 部分难溶物的颜色和常温下的Ksp如下表所示:
部分难溶物的颜色和常温下的Ksp如下表所示:| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com