
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加KIO3 |
| D | 向苯酚钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.该气体可能为SO2或CO2,原溶液中可能含有HCO3-、HSO3-、SO32-中的一种或几种,不一定含有碳酸根离子;
B.铁与浓硫酸发生钝化现象,发生了化学变化;
C.淀粉遇碘变蓝,是碘单质的性质,不是碘元素;
D.溶液变浑浊,说明生成了苯酚,根据强酸制取弱酸的原理分析.
解答 解:A.能使澄清石灰水变浑浊的气体有SO2或CO2,则溶液中可能含有HCO3-、HSO3-、SO32-等离子,不一定含有CO32-,故A错误;
B.铁与浓硫酸发生钝化现象,即在铁表面生成一层致密的氧化物薄膜,阻止进一步被氧化,发生了化学变化,故B错误;
C.淀粉遇I2溶液才变蓝,要检验KIO3,需要先将IO3-转化为I2,故C错误;
D.苯酚钠与乙酸反应生成苯酚,溶液变浑浊,则说明乙酸的酸性强于苯酚,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及离子检验、酸性强弱比较、钝化现象实质等知识,明确常见元素及其化合物性质为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学实验能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | NH3+HCl═NH4Cl | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | Cl2+2NaOH=NaCl+NaClO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
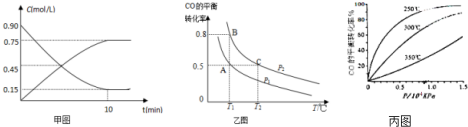
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
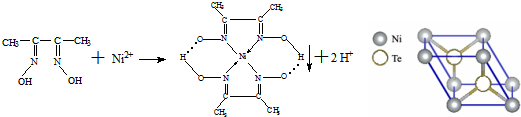
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
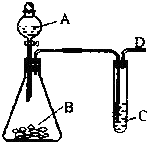 某同学用如图所示的装置来探究SO2的性质及有关实验.
某同学用如图所示的装置来探究SO2的性质及有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:7 | C. | 1:6 | D. | 5:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com