
分析 (1)①根据外界条件对平衡的影响来确定平衡移动方向;根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡;
②在酸性条件下Cr2O72-与亚铁离子发生氧化还原反应;根据氧化还原反应中得失电子守恒来计算;
③浓度对平衡的影响;氢氧根的浓度较大且过量;
④氢离子的浓度对平衡i、ii的影响;
(2)①铁在阳极反应发生反应Fe-2e-═Fe2+,为还原Cr2O72-提供还原剂Fe2+,则应该用Fe作阳极;
②溶液中氢离子在阴极放电生成氢气,导致阴极附近氢离子浓度降低;
③亚铁离子被氧化生成Fe3+,Fe3+和OH-反应生成Fe(OH)3沉淀.
解答 解:(1)①c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色;
a.Cr2O72-和CrO42-的浓度相同,达到平衡时,是浓度保持不变,不是相同,故a错误;
b.要方向相反,且速率之比与计量数之比成比例,说明达到平衡,而ν正(Cr2O72-)=2ν逆(CrO42-)不满足与计量数成比例,故b错误;
c.溶液的颜色不变,说明有颜色的离子浓度不变,达到平衡,故c正确;
d.溶液的pH不变,说明氢离子浓度不变,达到平衡,故d正确;
故答案为:橙;cd;
②在酸性条件下Cr2O72-与与亚铁离子发生氧化还原反应,
反应方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;
根据电子得失守恒:n(Cr2O72-)×6=n(FeSO4•7H2O)×1,n(FeSO4•7H2O)=$\frac{1mol×6}{1}$=6mol,
故答案为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;6;
③向含Cr3+(紫色)溶液中,逐渐滴加NaOH溶液,氢离子浓度减小,溶液pH增大,平衡 Cr(OH)3(s)+H2O?[Cr(OH)4]- (亮绿色)+H+正向移动,故溶液逐渐变为亮绿色;若向0.05mol•L-1的Cr2(SO4)3溶液50mL中,一次性加入等体积0.6mol•L-1的NaOH溶液,氢氧根的浓度较大且过量,平衡向右移彻底,溶液由紫色最终变为亮绿色;
故答案为:随着溶液pH增大,平衡 Cr(OH)3(s)+H2O?[Cr(OH)4]- (亮绿色)+H+正向移动,故溶液逐渐变为亮绿色;溶液由紫色最终变为亮绿色;
④在K[Cr(OH)4]和K2Cr2O7混合溶液中加入足量H2SO4酸化,
i.2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
ii.Cr(OH)3(s)+H2O?[Cr(OH)4]- (亮绿色)+H+
氢离子浓度足够大,i向右移,ii向左移,氢氧化铬溶解,得到Cr3+,所以铬元素以Cr3+和Cr2O72-存在,
故答案为:Cr3+和Cr2O72-;
(2)①铁在阳极反应发生反应Fe-2e-═Fe2+,为还原Cr2O72-提供还原剂Fe2+,则应该用Fe作阳极,
故答案为:铁在阳极反应发生反应Fe-2e-═Fe2+,为还原Cr2O72-提供还原剂Fe2+;
②溶液中氢离子在阴极放电生成氢气,导致阴极附近氢离子浓度降低,溶液的pH升高,
电极反应式为2H++2e-=H2 ↑,
故答案为:阴极发生反应2H++2e-═H2↑,导致c(H+)下降;
③亚铁离子被氧化生成Fe3+,Fe3+和OH-反应生成Fe(OH)3沉淀,
故答案为:Fe(OH)3.
点评 本题主要考查了化学平衡移动原理、氧化还原反应、沉淀溶解平衡等内容.解题根据题给信息,再结合相关原理可进行解答本题考查氧化还原反应计算、电解原理、物质分离和提纯等知识点,为高频考点,侧重考查学生分析计算能力,明确氧化还原反应中转移电子守恒是解本题关键,题目综合性强.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的溴(苯) | B. | 甲烷中的乙烯(溴水) | ||
| C. | 乙醇中的水(金属钠) | D. | 甲烷中的乙烯(酸性高锰酸钾溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
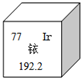 2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )
2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )| A. | 铱的相对原子质量为192.2克 | |
| B. | 铱原子核内的中子数为77 | |
| C. | K2IrO3中Ir的化合价为+4 | |
| D. | 生活中常用的铱金笔为纯净的铱单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
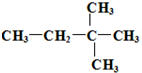 由另一种烃D通过加成反应而制得,则烃D的可能的是
由另一种烃D通过加成反应而制得,则烃D的可能的是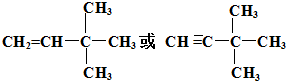 (任写一种可能的结构简式)
(任写一种可能的结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.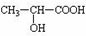 +CH3CH2OH $→_{△}^{浓硫酸}$
+CH3CH2OH $→_{△}^{浓硫酸}$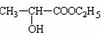 +H2O,
+H2O,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:B>C>D>A | |
| B. | 氢化物的稳定性:C>D | |
| C. | B和其他3种元素均能形成离子化合物 | |
| D. | B与D形成的化合物溶于水所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L己烷分子数约为NA | |
| B. | 1 mol甲基含10 NA个电子 | |
| C. | 在人体内,180g葡萄糖完全被生理氧化所消耗的氧气的分子数为6NA | |
| D. | 0.5mol 1,3-丁二烯(CH2=CHCH=CH2)分子中含有碳碳双键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com