


 ��E��������1��2-�������飮
��E��������1��2-�������飮 ��
�� ��G�ж���ͬ���칹�壬д��������ͬʱ������������������ͬ���칹��Ľṹ��ʽ��
��G�ж���ͬ���칹�壬д��������ͬʱ������������������ͬ���칹��Ľṹ��ʽ��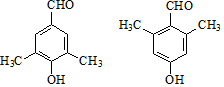 ��
�� ��
�� ���� ������A����Ԫ�ص���������Ϊ8.7%��A������ͼ�У��������ӷ��Ӧ������ʺɱ�Ϊ92����N��H��=$\frac{92��8.7%}{1}$=8����N��C��=$\frac{92����1-8.7%��}{12}$=7����AΪ ��D�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ��ӦΪCH2=CH2����ת����ϵ��֪EΪCH2ClCH2Cl��FΪCH2OHCH2OH������Ϣ�ڿ�֪BΪ
��D�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ��ӦΪCH2=CH2����ת����ϵ��֪EΪCH2ClCH2Cl��FΪCH2OHCH2OH������Ϣ�ڿ�֪BΪ ��NΪ
��NΪ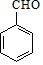 ��GΪ
��GΪ ���Դ˽����⣮
���Դ˽����⣮
��� �⣺��1�������Ϸ�����֪AΪ ��EΪ������Ϊ1��2-�������飬�ʴ�Ϊ��
��EΪ������Ϊ1��2-�������飬�ʴ�Ϊ�� ��1��2-�������飻
��1��2-�������飻
��2��DΪCH2=CH2�������������ӳɷ�Ӧ����CH2ClCH2Cl��CH2ClCH2Cl������������Һ������������ˮ������CH2OHCH2OH��
�ʴ�Ϊ���ӳɷ�Ӧ������������Һ�����ȣ�
��3������Ϣ��֪��B����N�Ļ�ѧ����ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��4����ά����C�ṹ��֪�����������ǻ����ʴ�Ϊ���������ǻ���
��5��GΪ ����Ӧ��ͬ���칹��ټ��ܷ���������Ӧ��������FeCl3������ɫ��Ӧ��˵�����з��ǻ���ȩ�����ں˴Ź�������Ϊ4��壬��ṹ�Գƣ���Ϊ
����Ӧ��ͬ���칹��ټ��ܷ���������Ӧ��������FeCl3������ɫ��Ӧ��˵�����з��ǻ���ȩ�����ں˴Ź�������Ϊ4��壬��ṹ�Գƣ���Ϊ ��
��
�ʴ�Ϊ�� ��
�� ��
��
��6����2-��ϩΪԭ���Ʊ�˳�������������������ӳɷ�Ӧ����2��3-���ȶ��飬Ȼ������ȥ��Ӧ����1��3-����ϩ�����ڴ������·����Ӿ۷�Ӧ�����ɲ����Ӧ������Ϊ ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���л�����ƶϣ�Ϊ�߿��������ͣ����ؿ���ѧ���ķ�����������Ŀ�漰ϩ��������ȩ���ѵ�������ת������Ŀ������ǿ�������̲ģ�ע�����֪ʶ�����գ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH�ĵ���ʽ��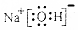 | B�� | �����ӵĽṹʾ��ͼ��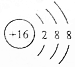 | ||
| C�� | �������Ʒ���ʽ��NaClO | D�� | Na2O2�й������ӵĻ�ѧʽ��O22- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ȫ��Һ����س��ʱ��̣���������ǿ������Ϊ��������ء�������ԭ����ͼ����֪��Ӧ�����ӷ���ʽ��VO2++V3++H2O$?_{�ŵ�}^{���}$VO2++V2++2H+����������������ǣ�������
ȫ��Һ����س��ʱ��̣���������ǿ������Ϊ��������ء�������ԭ����ͼ����֪��Ӧ�����ӷ���ʽ��VO2++V3++H2O$?_{�ŵ�}^{���}$VO2++V2++2H+����������������ǣ�������| A�� | �ŵ�ʱ�������缫��ӦΪ��VO2++e-+2H+=VO2++H2O | |
| B�� | ���ʱ�������缫��ӦΪ��V3++e-=V2+ | |
| C�� | �ŵ�ʱ��H+�ӵ���ұ�������� | |
| D�� | ���øõ�ص�ⱥ��NaCl��Һ��ʯī���缫����2 mol VO2+����������Ӧʱ������������44.8 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������صĸ��� | |
| B�� | ���������ӦΪFeS2+4Li++4e-�TFe+2Li2S | |
| C�� | �ŵ�ʱ��Li+��Ǩ�� | |
| D�� | ����ܷ�ӦΪFeS2+4Li�TFe+2Li2S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ�� | ���� | ���� |
| A | �ⶨ��Ũ�ȵ�Na2CO3��Na2SiO3��Һ��pH | Na2SiO3��Һ��pH�� | �ǽ����ԣ�C��Si |
| B | ��ϡ������뵽̼����У��ű���ʳ��ˮ�ռ����� | �ռ���һ�������� | ʵ���ҿ��ô˷��Ʊ�CO2 |
| C | ��4mL 0.01mol/L����KMnO4��Һ��2mL 0��lmol/L������Һ��� | KMnO4��Һ��ɫ������������ӿ� | ����Ӧ��Ũ�ȣ� ��Ӧ���ʼӿ� |
| D | ��NO2����ͨ��ʯ����Һ�� | ��Һ��� | NO2������������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 56g��������������ȼ�գ�ת�Ƶĵ�����Ϊ2NA | |
| B�� | 1g��������NA���������� | |
| C�� | ��״���£�22.4 Lˮ����1 molˮ���� | |
| D�� | 2 mol�������ϡ���ᷴӦ����NA���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ϡ�����м����������������������ĵ���̶� | |
| B�� | 25��ʱ���������Ũ�ȵ������백ˮ��Ϻ���ҺpH=7 | |
| C�� | 0.1molAgCl��0.1molAgl��Ϻ����1 Lˮ�У�������Һ��c��Cl-����c��I-�� | |
| D�� | 25��ʱ��0.1mol/L��������Һ�ȵ�Ũ�ȵ�������Һ�ĵ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
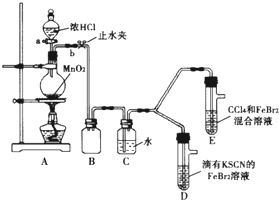 ij��ѧ��ȤС��Ϊ̽��Cl2��Br2��Fe3+��������ǿ�������������ʵ�飺
ij��ѧ��ȤС��Ϊ̽��Cl2��Br2��Fe3+��������ǿ�������������ʵ�飺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com