
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列选项正确的是

A.Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
B.Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C.Na2S4O6、H2O、Na2S2O3、Au2O、NaOH
D.当1 mol Au2O3完全反应时,转移电子的物质的量为8 mol
科目:高中化学 来源:2016届安徽省三校高三上学期二次模拟化学试卷(解析版) 题型:填空题
(10分)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液于试管中,加入KSCN溶液后无明显变化。
Ⅲ.另取少量溶液于试管中,加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________(写离子符号)。
(2)甲同学最终确定原溶液中所含阴离子是________(写离子符号)。
(3)Ⅲ中加入少量盐酸生成无色气体的离子方程式是________________________。
(4)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为________g。
(5)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是________。
选项 | 污染物 | 处理措施 | 方法类别 |
A | 废酸 | 加生石灰中和 | 物理法 |
B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
D | 碱性的废水 | 用CO2中和 | 化学法 |
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.FeCl2溶液中通入氯气:Fe2++Cl2═Fe3++2Cl﹣
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH﹣+HCO3﹣═CaCO3↓+H2O
C.FeS固体放入稀硝酸溶液中:FeS+2H+═Fe2++H2S↑
D.碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH﹣+HCO3﹣═CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期半期考试化学试卷(解析版) 题型:选择题
n L三种气态烃混合物与足量氧气混合点燃后,恢复到原来状态(常温常压),体积共缩小2n L,这三种烃不可能的组合是
A.CH4、C2H4、C3H4以任意比混合
B.C2H6、C4H6、C2H2以2:1:2的物质的量之比混合
C.C3H8、C4H8、C2H2以11:14:26的质量之比混合
D.CH4、C3H6、C2H2以a:b:b体积比混合
查看答案和解析>>
科目:高中化学 来源:2016届山东省青岛市高三上学期10月月考化学试卷(解析版) 题型:选择题
下列实验过程中,始终无明显现象的是
A.NH3通入AlC13溶液中
B.CO2通入到CaCl2溶液中
C.用脱脂棉包裹Na2O2粉末露置在潮湿空气中
D.稀盐酸滴加到Fe(OH)3胶体溶液中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏丹阳中学高二上10月月考化学试卷(解析版) 题型:填空题
(10分)现有下列各化合物:

(1)上述各组化合物属于同系物的是 ,属于同分异构体的是 (填入编号);
(2)A、B、C中的化合物中含有的官能团是(写名称) 、 、 、 ;
(3)根据官能团的特点可将C中两化合物划分为 类和 类。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽师大附属中学高二上期中测试化学试卷(解析版) 题型:选择题
某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150,若已知其中氧的质量分数为50%,则分子中氧原子的个数可以是
A.1到4 B.2或3 C.只有4 D.1或4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上第一次月考化学试卷(解析版) 题型:选择题
在密闭容器中进行如下反应:X2(气) + Y2(气)  2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L、0.3 mol/L、0.2 mol/L, 在一定的条件下, 当反应达到平衡时,各物质的浓度有可能是
2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L、0.3 mol/L、0.2 mol/L, 在一定的条件下, 当反应达到平衡时,各物质的浓度有可能是
A.Y2为0.2 mol/L B.Y2 为0.35 mol/L
C.X2 为0.2 mol/L D. Z为 0.4 mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期10月月考化学试卷(解析版) 题型:填空题
合成氨工业的核心反应是N2(g)+3H2(g) 2NH3(g);反应过程中能量变化如图所示,回答下列问题。
2NH3(g);反应过程中能量变化如图所示,回答下列问题。
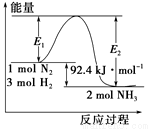
(1)该反应的ΔH=____________kJ/mol。
(2)在反应体系中加入催化剂,反应速率增大,E1的变化:E1__________(填“增大”、“减小”或“不变”)。
(3)在500℃、2×107Pa和催化剂条件下,向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量____________46.2 kJ (填“<”、“>”或“=”) 。
(4)关于该反应的下列说法中,正确的是________(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
(5)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)===P4O10(s) ΔH 1=-2983.2 kJ·mol-1
P(s,红磷)+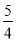 O2(g)===
O2(g)=== 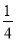 P4O10(s) ΔH 2=-738.5 kJ·mol-1
P4O10(s) ΔH 2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com