
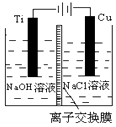
·ÖĪö MŹĒĖÄÖÖŌŖĖŲ×é³ÉµÄ¹ĢĢ壬ČÜÓŚĖ®ŗóČÜŅŗĪŖŃŖŗģÉ«£¬ĖµĆ÷MĪŖFe£ØSCN£©3£¬Fe£ØSCN£©3Óė×ćĮæÅØĻõĖįŌŚ¼ÓČČĢõ¼žĻĀ·“Ó¦£¬»ģŗĻĘųĢåAÖŠŗ¬ÓŠŗģ×ŲÉ«ĘųĢåNO2£¬·“Ó¦ŗóµÄČÜŅŗÖŠŗ¬ÓŠSO42-µÄĪļÖŹµÄĮæÓė6.99gBaSO4µÄĻąĶ¬£¬Fe3+µÄĪļÖŹµÄĮæŹĒ0.8gFe2O3µÄ2±¶£¬°×É«³ĮµķBÄÜČܽāŌŚĻ”ŃĪĖįÖŠ£¬²¢²śÉśĪŽÉ«ĪŽĪ¶µÄĘųĢåŌŚ±źæöµÄĢå»żĪŖ0.672L£®ĖµĆ÷AÖŠŗ¬ÓŠCO2£¬Ź£ÓąĘųĢåCĪŽÉ«ĪŽĪ¶£¬ÄÜŹ¹Č¼ÉÕµÄľĢõĻØĆš£¬æÉÅŷŵ½æÕĘųÖŠ£¬²»»įøıäæÕĘųµÄ³É·Ö£¬ĖµĆ÷ĘųĢåCŹĒN2£®
½ā“š ½ā£ŗ£Ø1£©MŹĒĖÄÖÖŌŖĖŲ×é³ÉµÄ¹ĢĢ壬ČÜÓŚĖ®ŗóČÜŅŗĪŖŃŖŗģÉ«£¬ĖµĆ÷MĪŖFe£ØSCN£©3£¬
¹Ź“š°øĪŖ£ŗFe£ØSCN£©3£»
£Ø2£©ŗģ×ŲÉ«ĘųĢåŹĒNO2£¬°×É«³ĮµķBÄÜČܽāŌŚĻ”ŃĪĖįÖŠ£¬²¢²śÉśĪŽÉ«ĪŽĪ¶µÄĘųĢåŌŚ±źæöµÄĢå»żĪŖ0.672L£¬ĖµĆ÷AÖŠŗ¬ÓŠCO2£¬Ź£ÓąĘųĢåCĪŽÉ«ĪŽĪ¶£¬ÄÜŹ¹Č¼ÉÕµÄľĢõĻØĆš£¬æÉÅŷŵ½æÕĘųÖŠ£¬²»»įøıäæÕĘųµÄ³É·Ö£¬ĖµĆ÷ĘųĢåCŹĒN2£¬
¹Ź“š°øĪŖ£ŗNO2”¢CO2”¢N2£»
£Ø3£©ĶłĀĖŅŗÖŠ¼Ó×ćĮæNaOHČÜŅŗ£¬²śÉśŗģŗÖÉ«³Įµķ£¬ĖµĆ÷ĶŹÉ«ŗóµÄČÜŅŗÖŠŗ¬ÓŠFe3+£¬µĪ¼ÓKSCNČÜŅŗ£¬ČÜŅŗ±äĪŖŃŖŗģÉ«£¬
¹Ź“š°øĪŖ£ŗČÜŅŗ±äĪŖŃŖŗģÉ«£»
£Ø4£©Fe£ØSCN£©3µÄĪļÖŹµÄĮæŹĒ$\frac{2.3g}{230g/mol}$=0.01mol£¬ÓėÅØĻõĖį·“Ó¦µĆµ½SO42-µÄĪļÖŹµÄĮæĪŖ$\frac{6.99g}{233g/mol}$=0.03mol£¬Fe3+µÄĪļÖŹµÄĮæĪŖ2”Į$\frac{0.8}{160g/mol}$=0.01mol£¬N2µÄĪļÖŹµÄĮæĪŖ$\frac{0.42g}{28g/mol}$=0.015mol£¬CO2µÄĪļÖŹµÄĮæĪŖ$\frac{0.672L}{22.4L/mol}$=0.03mol£¬øł¾ŻĪļÖŹµÄĮæÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±ČæɵƷ“Ó¦·½³ĢŹ½ĪŖ£ŗ
2Fe£ØSCN£©3+66HNO3£ØÅØ£©$\frac{\underline{\;¼ÓČČ\;}}{\;}$Fe2£ØSO4£©3+3H2SO4+3N2”ü+6CO2”ü+66NO2”ü+30H2O£¬Ņņ“ĖŃõ»Æ¼ĮŗĶ»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ66£ŗ2=33£ŗ1£¬
¹Ź“š°øĪŖ£ŗ33£ŗ1£»
£Ø5£©Ļņ“ż¼ģŅŗÖŠĻȵĪ¼ÓKSCNČÜŅŗ£¬ĪŽ±ä»Æ£¬ŌŁµĪ¼ÓŠĀÖʵÄĀČĖ®£¬ČÜŅŗĻŌŗģÉ«£¬ĖµĆ÷ŗ¬Fe2+£¬ÓÉÓŚÅØĻõĖįÄÜŹ¹Fe£ØSCN£©3ČÜŅŗĶŹÉ«£¬ĖłŅŌ²»ÄÜÓĆÅØĻõĖįĢę“śĀČĖ®£¬
¹Ź“š°øĪŖ£ŗ²»ÄÜÓĆÅØĻõĖįĢę“śĀČĖ®£®
µćĘĄ ±¾Ģāæ¼²éĪŽ»śĪļµÄĶʶĻ£¬ĪŖøßĘµæ¼µć£¬ĘäÖŠÉę¼°Ąė×Ó·“Ó¦¼°Ąė×Ó¼ģŃ锢Ńõ»Æ»¹Ō·“Ó¦ŌĄķµČÖŖŹ¶µć£¬ÕĘĪÕĪļÖŹµÄŠŌÖŹŹĒ½āĢā¹Ų¼ü£¬ĘäÖŠ£Ø4£©ÄŃ¶Č½Ļ“ó£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
| ĪĀ¶Č/”ę | 1000 | 1150 | 1300 |
| Ę½ŗā³£Źż | 42.9 | 50.7 | 64.0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ķā¹Ū»ė×Ē²»Ēå | B£® | ·ÖÉ¢ĻµĮ£×ÓÖ±¾¶“óÓŚ100nm | ||
| C£® | ²»ĪČ¶Ø | D£® | ²»ÄÜ·¢Éś¶”“ļ¶ūĻÖĻó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µŚ¢ńA×åŌŖĖŲ¶¼ŹĒµäŠĶµÄ½šŹōŌŖĖŲ | |
| B£® | ¹ż¶ÉŌŖĖŲ¶¼ŹĒ½šŹōŌŖĖŲ | |
| C£® | ČĪŗĪŌŖĖŲµÄŌ×Ó¶¼ŹĒÓÉŗĖĶāµē×ÓŗĶŗĖÄŚÖŹ×Ó”¢ÖŠ×ÓĖł×é³É | |
| D£® | ¾łŹō”°ļēĻµŌŖĖŲ”±µÄļē£Ø57La£©Óėīę£Ø58Ce£©»„ĪŖĶ¬Ī»ĖŲ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ÄÉĆ×¼¶Cu2OÓÉÓŚ¾ßÓŠÓÅĮ¼µÄ“߻ƊŌÄܶų±øŹÜ¹Ų×¢£¬ĻĀ±ķĪŖÖĘČ”ÄÉĆ×¼¶Cu2OµÄČżÖÖ·½·Ø£ŗ
ÄÉĆ×¼¶Cu2OÓÉÓŚ¾ßÓŠÓÅĮ¼µÄ“߻ƊŌÄܶų±øŹÜ¹Ų×¢£¬ĻĀ±ķĪŖÖĘČ”ÄÉĆ×¼¶Cu2OµÄČżÖÖ·½·Ø£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 6.2g°×Į×ÖŠĖłŗ¬P-P¼üµÄŹżÄæĪŖ0.15NA | |
| B£® | ŗ¬H2O2 3.4æĖµÄČÜŅŗĶźČ«·Ö½ā£¬Ęäµē×Ó×ŖŅĘŹżÄæĪŖNA | |
| C£® | 117gĀČ»ÆÄĘ¹ĢĢåŗ¬ÓŠ2NAøöĀČ»ÆÄĘ·Ö×Ó | |
| D£® | 6æĖ½šøÕŹÆŗ¬NAøöC-C¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŗćĪĀĻĀĻņČÜŅŗÖŠ¼ÓČėCaO£¬Ca2+Ąė×ÓŹżÄæ¼õÉŁ | |
| B£® | ŗćĪĀĻĀĻņČÜŅŗÖŠ¼ÓČėCaO£¬ČÜŅŗÖŠC£ØCa2+£©¼õŠ” | |
| C£® | øųČÜŅŗ¼ÓČČ£¬ČÜŅŗµÄpH²»±ä | |
| D£® | øųČÜŅŗ¼ÓČČ£¬ČÜŅŗµÄĄė×ÓÅضČŌö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com