
(16分)苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:
C6H5C2H5(g) C6H5CH=CH2(g)+H2 (g) △H=+125kJ·mol-1
C6H5CH=CH2(g)+H2 (g) △H=+125kJ·mol-1
(1)该反应的平衡常数表达式为K= __ _____________ 。随着温度的升高,K值________(填“增大”、“减小”或“不变”,下同)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。

①由上图可得出:
结论一:其他条件不变,水蒸气的用量越大,平衡转化率越______;
结论二:__________________________________________________。
②加入稀释剂能影响C6H5C2H5平衡转化率的原因是:_______________________。
(3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。试解释其原因:_______________________________________________。
(1) K=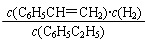 (2分)
增大 (3分)
(2分)
增大 (3分)
(2)①高 (1分) 其他条件不变,体系总压强越大,平衡转化率越小。 (3分)
②总压不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,C6H5C2H5的平衡转化率增大。(4分)
(或答:总压不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,浓度商的计算结果小于平衡常数K,故平衡向正反应方向移动,C6H5C2H5的平衡转化率增大。)
(3)O2将反应生成的H2消耗掉,减小了H2的浓度,同时该反应放热使体系升温,两种因素均使平衡向正反应方向移动。 (3分)
【解析】平衡常数是指可逆反应在一定条件下达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以K= 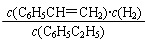 。正反应是吸热反应,升高温度,平衡向正反应方向移动,所以平衡常数增大。
。正反应是吸热反应,升高温度,平衡向正反应方向移动,所以平衡常数增大。
(2)①根据图像可知,水蒸气的用量越大,平衡转化率越高。根据不同压强下的转化率可判断,其他条件不变,体系总压强越大,平衡转化率越小。
②因为在总压不变时,加入稀释剂,容器容积必然增大,即参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,C6H5C2H5的平衡转化率增大。
(3)因为O2能将反应生成的H2消耗掉,减小了H2的浓度,同时该反应放热使体系升温,两种因素均使平衡向正反应方向移动。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
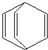 桶烯(Barrelene)结构简式如图所示,则下列有关说法不正确的是( )
桶烯(Barrelene)结构简式如图所示,则下列有关说法不正确的是( )| A、桶烯中的一个氢原子被氯原子取代,所得产物只有二种 | B、桶烯在一定条件下能发生加成反应和加聚反应 | C、桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体 | D、桶烯分子中所有原子在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:
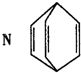
| A、N在一定条件下能发生加聚反应 | B、N分子中所有的原子在同一平面内 | C、N与苯乙烯(C6H5CH=CH2)互为同分异构体 | D、N中的一个氢原子被氯原子取代,所得产物只有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
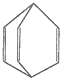
| A、桶烯分子中所有的原子不可能在同一平面上 | B、桶烯中的一个氢原子被氯原子取代,所得产物有三种 | C、桶烯与苯乙烯(C6H5CH═CH2)互为同分异构体 | D、桶烯在一定条件下能发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com