
【题目】某同学要在奥运五连环中填入物质,使相连物质间能发生反应,不相连物质间不能发生反应。你认为“五连环”中有空缺的一环应填入的物质是( )

A. 硫酸 B. 氧气 C. 二氧化碳 D. 氧化钙
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. Fe(SCN)3溶液中加入固体KSCN后颜色变深
D. 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“五室电渗析法”处理含硫酸钠废水的原理如图所示,以石墨为电极材料,室与室之间用离子交换膜分开(阳膜和阴膜分别只允许阳离子、阴离子通过),下列说法不正确的是 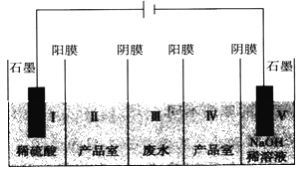
A. 阳极反应式为2H2O-4e-==O2↑+4H+,发生氧化反应
B. 通电片刻后,I、III、V室的pH依次减小、不变、增大
C. 当电路中通过1mol电子时,有1molSO42-从III室进入Ⅱ室
D. 总反应式为Na2SO4+4H2O![]() 2NaOH+H2SO4+O2↑+2H2↑
2NaOH+H2SO4+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。某实验兴趣小组将无水FeC13与氯苯混合发生反应:2FeCl3+C6H5Cl![]() 2FeC12+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeC13的转化率,同时得到常用的还原剂FeC12。按照如图装置,在三颈烧瓶中放入162.5g无水FeC13与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
2FeC12+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeC13的转化率,同时得到常用的还原剂FeC12。按照如图装置,在三颈烧瓶中放入162.5g无水FeC13与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
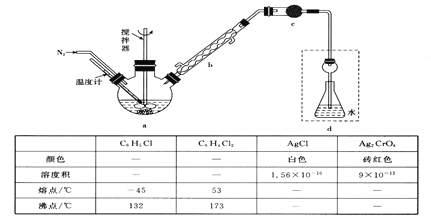
回答下列问题:
(1)仪器c的名称是_______________,盛装的试剂是___________________。
(2)仪器b球形冷凝管的作用是_________________________________。
(3)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是____________(填序号)。
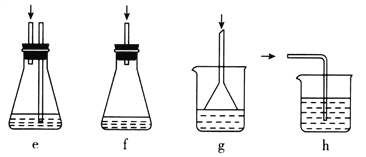
(4)如何从滤液中回收过量的氯苯:_______________________________________。
(5)将锥形瓶内的溶液稀释至1000mL,从中取10.00mL,滴加几滴K2CrO4作指示剂,用0.2000mol·L-1AgNO3溶液进行滴定,当达到终点时,消耗22.50mL AgNO3溶液。
①滴定终点的现象是________________________,使用棕色滴定管进行滴定的原因是________________________________________。
②无水FeC13的转化率![]() =__________%。
=__________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应FeO(s)+C(s)=CO(g)+ Fe(s) 的△H>0,△S >0(假定△H、△S不随温度而变化),下列叙述中正确的是( )
A. 低温下为自发过程,高温下为非自发过程 B. 高温下为自发过程,低温下为非自发过程
C. 任何温度下均为非自发过程 D. 任何温度下均为自发过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸的组成用H2C2O4表示,为了测定某草酸溶液的浓度,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amolL﹣1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.
试回答:
(1)实验中,标准液KMnO4溶液应装在_____式滴定管中,因为______________.
(2)实验中眼睛注视_____________________,直至滴定终点.判断到达终点的现象是_________.
(3)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A. 滴定前仰视刻度,滴定后俯视刻度_________.
B. 锥形瓶在盛放待测液前未干燥,有少量蒸馏水_________.
C. 滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质(见下图),下列说法正确的是( )

A. 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸→过滤
B. 步骤②中反应利用的原理是:相同条件下NaHCO3的溶解度比NaCl小
C. 步骤③在工业上通过向母液中加NaOH固体实现
D. 步骤④利用了Br2的挥发性、还原性,该步的作用是富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各题所给出的数据,得出的结论正确的是( )
A. 通入标准状况下 HCl 气体 11.2L,可使 1 L 浓度为 0.5mol/L 的盐酸物质的量浓度增大到 1mol/L
B. 在 10%的 NaOH 溶液中,平均每 9 个水分子溶有 1 个 OH-
C. 将 10g 碳酸钙粉末加水配成 100ml 溶液,CaCO3 物质的量浓度为 1mol/L
D. 4g NaOH 溶解在 10mL 水中,再稀释成 1L,从中取 1mL,这 1mL 溶液的物质的量浓度为 0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com