
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入石蕊溶液中,溶液变红 | |
| B. | 铁粉与高温水蒸气反应时,固体逐渐变黑 | |
| C. | 将一定量草酸溶液与高锰酸钾溶液混合静置,观察发现溶液褪色速率逐渐变慢 | |
| D. | 将少量CuSO4固体加入无水乙醇中,振荡后静置,上层清液即为CuSO4胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
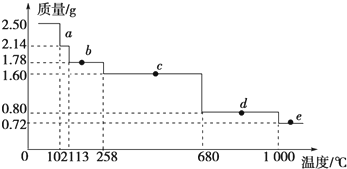
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.50g | B. | 4.00g | C. | 3.73g | D. | 7.45g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于0.125mol | |
| B. | 可能小于0.125mol,也可能大于0.125mol | |
| C. | 小于0.125mol | |
| D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g金刚中含共价键数目为2NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,生成物的分子数为2NA | |
| C. | 常温下,10L,PH=13的Ba(OH)2溶液含OH-的数目为NA | |
| D. | 过氧化钠与水反应时,生成1molO2时转移电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com